© 2016 Ralph Zehr
© 2016 Association Francophone des Lecteurs du Livre d'Urantia
¶ Ralph D. Zehr
¶ Biografía profesional
Ralph D. Zehr recibió su título de médico en SUNY Upstate Medical Center, Syracuse, Nueva York, en 1964. Después de un año de pasantía en el Hospital Harrisburg en Pensilvania y un año de beca postdoctoral en la Universidad de Londres, Inglaterra, donde recibió el título de médico. Diplomado en Medicina Clínica Tropical (DCTM Lon.; sirvió dos años más en Ghana, África Occidental). Al regresar a Estados Unidos, realizó tres años de prácticas en el Hospital Robert Packer de Sayre, Pensilvania, especializándose en radiología. Después de completar su pasantía, se unió inmediatamente al equipo de gestión médica y pasó toda su carrera médica en la Clínica Guthrie, un gran grupo regional multiespecializado de varios cientos de médicos y proveedores de atención primaria con tres hospitales y una gran cantidad de pacientes ambulatorios ubicados en la zona rural del sur. Nueva York y el norte de Pensilvania. Esta unidad funciona como una gran infraestructura médica integrada que se centra en atención médica de alta calidad, investigación médica básica y clínica y una amplia gama de educación médica.

Dedicó una parte importante de su tiempo a enseñar radiología a tecnólogos, estudiantes de medicina junior y senior, residentes de radiología e hizo frecuentes presentaciones y conferencias a varios grupos del equipo médico senior. Ocupó un cargo académico en SUNY Upstate Medical Center durante muchos años. Durante diez años se desempeñó como editor del Guthrie Medical Journal, una revista médica regional con una circulación de más de 7.600 suscriptores, principalmente médicos.
Durante su carrera, sus responsabilidades administrativas fueron considerables. Se desempeñó durante un período de ocho años en el Comité Ejecutivo del Personal Médico, incluidos dos años como secretario, dos años como vicepresidente, dos años como presidente y dos años como ex presidente. Fue nombrado presidente del departamento de radiología, que requiere la supervisión de todos los servicios de diagnóstico radiológico, incluidas las actividades educativas, en los tres hospitales y clínicas ambulatorias de la región.
Desde entonces, ya no ha tenido responsabilidades clínicas, pero continúa formando parte de la junta directiva de la Fundación Donald Guthrie, que supervisa los programas de educación e investigación, dos áreas que han sido de gran interés personal a lo largo de su carrera.
Elaborar esta comunicación, centrada principalmente en la biología celular molecular, fue una experiencia realmente fascinante. Los avances tecnológicos que han permitido estudiar la biología celular a nivel molecular han sido realmente sorprendentes. En múltiples formas, son paralelos a los avances que se produjeron en las imágenes radiológicas y que continuaron a lo largo de su carrera. ¡Del 80 al 90% de los datos de imágenes generados en el campo de la radiología cuando se jubiló ni siquiera se imaginaban al comienzo de su carrera! Muchos de estos mismos avances tecnológicos también han contribuido a nuestra capacidad de obtener imágenes de la actividad intracelular a nivel molecular.
¶ biografía personal
El Libro de Urantia, con sus enseñanzas profundas e innovadoras, entró en la vida de Ralph y su esposa Betty en el otoño de 1967 durante una misión médica a Ghana. Su efecto en sus vidas fue inmediato y continúa cuarenta años después. No hay palabras para expresar su gratitud por encontrar el libro tan temprano en sus carreras profesionales y como padres. Betty y Ralph tienen dos hijos adultos, ambos lectores, y tres nietos. Betty es maestra de escuela pública jubilada y especialista en lectura, Ralph es radiólogo jubilado desde 2009 después de completar 45 años de práctica médica.
Ralph es miembro fundador de la Asociación Urantia de Pensilvania, donde ocupa varios puestos ejecutivos. Betty y Ralph han organizado numerosas reuniones bianuales en su casa como parte de la asociación y también han albergado varios grupos de estudio durante muchos años.
Ambos están muy implicados en la gestión de la escuela UBIS de la que forman parte como patronos e imparten cursos muy concurridos y apreciados. También forman parte de muchos otros comités nacionales. Ralph también es fideicomisario asociado de la Fundación Urantia y goza de gran prestigio por su experiencia y su ayuda.
¶ Organismos unicelulares La explosión del Cámbrico — Nanomáquinas
Tantas piezas móviles: ¿cómo encajan entre sí?
Por Ralph D. Zehr M.D.
¶ Organismos unicelulares
Generalmente SE PENSA que la vida comenzó como un organismo unicelular. Por lo tanto, la comprensión de la morfología y la función, particularmente de los organismos unicelulares, es esencial para cualquier estudio serio sobre el origen de la vida. Todas las células vivas pertenecen a uno de dos grupos: procariotas o eucariotas.
Los procariotas parecen mucho más simples, carecen de la mayoría de los orgánulos excepto los ribosomas. Contienen una región en la que las moléculas de ADN están relativamente concentradas en la región central de la célula, a diferencia de los eucariotas en los que el ADN intracelular está encerrado dentro de una membrana o envoltura nuclear.
MI. coli ha sido el procariota más estudiado por su sencillez y la rapidez y facilidad con la que se reproduce. Su genoma completo ha sido descifrado. Aunque se podría haber esperado encontrar proteínas mucho más simples e interacciones intermoleculares menos complejas que las observadas en eucariotas, este no fue el caso. La microscopía electrónica reveló una colección relativamente grande de moléculas de ADN en un área llamada nucleoide en o cerca del centro del organismo, así como muchos ribosomas pequeños en el citosol. Entre el ADN y el ARNm tienen lugar complejos procesos interactivos, así como la síntesis de proteínas. El E. coli tienen múltiples flagelos que les confieren una movilidad asombrosa. Pueden reaccionar a su entorno moviéndose hacia fuentes de nutrientes, además de ralentizar su tasa metabólica cuando los alimentos escasean. Pueden reproducirse rápidamente mediante una división celular cada 20 minutos en circunstancias ideales. Un medio de cultivo bien preparado, inoculado con E. coli, incubado durante la noche puede producir millones de organismos vivos idénticos listos para estudiar a la mañana siguiente.
Difícilmente se puede mencionar el papel desempeñado por E. coli en la investigación sin reconocer cómo ayudó a dilucidar la «fuerza impulsora del protón» y la hipótesis quimiosmótica asociada, propuesta por Peter Mitchell en 1961. Reconoció un vínculo entre la transferencia de un electrón y la adenosina trifosfato (ATP) sintasa que genera ATP. Estaba convencido de que existía un fenómeno eléctrico asociado al proceso químico. Hubo un proceso de transferencia de electrones, en el que los electrones transmiten un gradiente de electrones a lo largo de una cadena de varias moléculas o a lo largo de las membranas celulares, cediendo su energía en pequeños incrementos a medida que pasan. En este proceso, los protones se acumulan fuera de la membrana, formando un radiante de protones conocido como «fuerza impulsora de protones». Luego transmiten su gradiente, máquinas motoras como la ATP sintasa. De hecho, fueron necesarios unos 16 años para que esta teoría fuera ampliamente aceptada. En 1978 Mitchell recibió el Premio Nobel de Química. No sólo quedó bien establecida su hipótesis quimioosmótica, sino que también se descubrió que estos fenómenos tienen lugar en muchas bacterias, en las mitocondrias animales y en los cloroplastos de todo el reino vegetal. (1)
Otro ejemplo de lo que podemos esperar encontrar en estudios posteriores sobre procariotas es la documentación reciente de la acuaporina en E.coli, que es muy específica y muestra un rápido flujo de agua a través de sus canales. Se espera que proporcione un modelo útil para el estudio adicional de las acuaporinas, que son un gran complejo de proteínas macromoleculares alojadas en las membranas celulares y generalmente son responsables de controlar el flujo de agua y glicerol dentro y fuera de las células. (2)
Aunque los procariotas muestran relativamente pocas estructuras subcelulares, parece haber una organización subcelular o compartimentación intracelular significativa a nivel molecular. Los microbiólogos Lucy Shapiro y Richard Losick dijeron: “El uso de microscopía electrónica con etiquetado de oro y microscopía fluorescente para estudiar la organización subcelular de las células bacterianas ha revelado una sorprendente expansión de la compartimentación y localización de las proteínas. Continúan describiendo ejemplos como la ADN polimerasa, las proteínas de división celular y el citoesqueleto bacteriano. (3)
Los eucariotas pueblan los cuerpos de todo el reino animal y representan nuestro concepto general de célula típica. Muestran una extensa compartimentación intracelular con un núcleo rodeado por una galaxia de orgánulos altamente sofisticados que realizan funciones específicas. Sus sistemas energéticos están bien definidos y altamente especializados. Los cloroplastos de las plantas funcionan como paneles solares, transformando la energía del espectro visible de la luz solar en energía química en forma de azúcares, almidón, celulosa y ATP, mientras que las mitocondrias animales transforman la energía química almacenada en los azúcares y almidones ingeridos, así como en los ácidos grasos. , en ATP. La energía también se puede extraer de proteínas y aminoácidos ingeridos innecesariamente si la dieta contiene un exceso de ellos.
Franklin M. Harold, profesor emérito de bioquímica de la Universidad Estatal de Colorado, cuya carrera profesional abarca 40 años de investigación centrada en microorganismos, nos ofrece esta interesante perspectiva sobre nuestra comprensión de la vida a partir de nuestro conocimiento de las células. En su reciente libro El camino de la célula, afirmó: «Los bioquímicos insisten, con razón, en que cuando diseccionamos células no encontramos nada más que moléculas; no hay fuerzas especiales para la vida, ningún plan cósmico, sólo moléculas cuyo Las contorsiones y los acoplamientos subrayan y explican todo lo que hace la célula. Así, Max Perutz, reflexionando sobre los mecanismos que permiten a E.coli detectar una fuente de nutrientes y nadar hacia ella, no encontró nada que no pudiera »reducirse a la química". Comparto este compromiso con una concepción material de la vida, pero hace doblemente necesario recordar que antes de que se diseccionaran las células, en la medida en que estaban vivas, exhibían capacidades que iban más allá de la química. La homeostasis, el comportamiento intencional, la reproducción, la morfogénesis y la descendencia con modificación no son parte del vocabulario de la química pero indican un nivel superior de orden. Justo cuando un catálogo de piezas pequeñas está a punto de completarse, la transición de la química molecular al orden supramolecular de la célula surge como un estupendo desafío para la imaginación. No se equivoque; aquí tocamos, si no el secreto mismo de la vida, al menos una capa esencial de este misterio de múltiples capas. Porque si la vida ha de explicarse de manera convincente en términos de materia y energía, la organización es todo lo que separa una sopa de sustancias químicas de una célula viva. (4) (negrita añadida)
¶ La explosión cámbrica: ¿cómo encaja?
La tasa esperada de aparición de nuevos filos, como predice la teoría de Darwin, seguiría una curva relativamente regular, logarítmica o exponencial a lo largo del tiempo. Como resultado de cambios pequeños e incrementales en el tamaño y la complejidad de los organismos vivos y basados en una larga serie de mutaciones casuales del código genético, seguidas de períodos intermedios de prueba y error que resultaron en la selección de los más aptos, uno podría esperar encontrar una rastro de fósiles que muestran los cambios progresivos de los filos primitivos, que, pasando de la simple organización y plan del cuerpo, pasando por numerosas etapas progresivas, irían hacia disposiciones morfológicas más complejas de las partes del cuerpo, características de filos más avanzados. Por lo tanto, esperaríamos ver un espectro largo y prolongado de nuevos filos que abarque siglos, mostrando un patrón de ramificación a medida que nuevas formas se ramifican aleatoriamente en todas direcciones.
Pero eso no es lo que sucedió según los fósiles que tenemos. Durante la explosión del Cámbrico, tal como se registra en los dos depósitos fósiles de Burgess Shale, al este de la Columbia Británica, Canadá, descubiertos por Charles Doolittle Walcott en 1909 y en los fósiles del Cámbrico encontrados en China cerca de Chengjiang y estudiados más recientemente, muy bien conservados y mejor descritos. fósiles, surge una historia completamente diferente. Los dos depósitos, situados casi a mitad de camino entre sí, muestran una imagen sorprendentemente similar de un Big Bang biológico (5), (6) en el que muchos filos y otros planos reconocidos de cuerpos aparecieron en un instante de tiempo geológico que representa aproximadamente 0,1% de la historia geológica total de la Tierra.
Pero, ¿por qué no encontramos evidencia fosilizada de organismos precursores más simples que mostrarían una progresión gradual en complejidad que conduzca a cada característica de un plan individual único de cada filo? De hecho, hay muy poca evidencia de formas intermedias en cualquiera de los filos. Los filos identificados muestran una considerable estabilidad morfológica. En otras palabras, no podemos aislar fósiles que muestren evidencia significativa de organismos más simples, progresando gradualmente en complejidad y conduciendo al plan corporal más avanzado del filo observado. Tampoco encontramos un registro fósil, ni en un tiempo geológico específico, ni a lo largo de la historia geológica, que ofrezca evidencia morfológica de una larga serie de etapas progresivas graduales que vinculen filos o que confirmen una progresión evolutiva a partir de organismos más simples.
Una discusión de todos los filos identificados en los depósitos del Cámbrico está más allá del alcance de esta presentación, pero parece apropiada una lista y una breve discusión de los más familiares. Esta lista incluye: braquiópodos, eldoniaiodes, anélidos, ctenóforos, hiolitos, cordados y artrodades.
Los cordados, caracterizados por la presencia de una notocorda, incluyen a todos los vertebrados. Un descubrimiento interesante en el depósito de fósiles de Chengjiang es la presencia de los tres subfilos de cordados, cefocordados, craneados y urocordados.
En su libro Wonderful Life, The Burgess Shale and the Nature of History, Stephen Jay Gould plantea dos preguntas relacionadas con la explosión del Cámbrico: (1) ¿Por qué apareció la vida multicelular tan tarde? (2) ¿Por qué estas criaturas anatómicamente complejas no tienen precursores directos simples en el registro fósil del Precámbrico? (7)
Los depósitos de fósiles del período Cámbrico en China muestran los detalles más exquisitamente finos, así como numerosas partes de tejidos blandos: "Los sedimentos del Cámbrico Inferior cerca de Chengjiang han conservado fósiles de tal excelencia como tejidos y órganos blandos, como ojos, intestinos, estómagos, glándulas digestivas; Se pueden observar con detalle los órganos de los sentidos, la epidermis, los pelos, la boca y los nervios. Incluso hay embriones de esponjas fosilizados en los estratos precámbricos cerca de Chengjiang. (8)
“Los estratos cámbricos muestran partes blandas del cuerpo de organismos parecidos a medusas (conocidos como Eldonia), como canales de agua radiantes y anillos nerviosos. Estos fósiles contienen incluso el contenido de los intestinos de varios tipos diferentes de animales, así como residuos de alimentos no digeridos en sus heces. » (9)

Trabajo reciente de Michael S.Y. Lee y sus colegas de la Universidad de Adelaide compararon las tasas evolutivas relativas de desarrollo, así como los desarrollos moleculares durante la explosión del Cámbrico, con los del período Cámbrico hasta los tiempos modernos. Eligieron estudiar los artrópodos porque son un grupo muy grande y diverso de animales que vivieron durante el período Cámbrico y desde entonces. Utilizando 395 caracteres morfológicos, 62 genes codificadores de proteínas y 20 puntos de calibración del registro fósil, los autores infirieron historias evolutivas utilizando varios métodos analíticos y los resultados de sus relaciones son consistentes con otras investigaciones recientes. (10) Concluyeron que la tasa de evolución del cambio morfológico durante el período Cámbrico fue cuatro veces la tasa promedio desde el período Cámbrico, mientras que la tasa promedio estimada de evolución molecular durante el período Cámbrico fue cinco veces la velocidad promedio desde ese momento. (11) (Ver Figuras 1 y 2 a continuación)
La tasa de evolución morfológica y molecular de los artrópodos aumentó de 4 a 5 veces durante la explosión del Cámbrico.
Es una gran suerte que hayamos encontrado un lecho de fósiles que contiene especímenes tan bien conservados en los que muchas de las partes blandas pueden identificarse claramente y se conserva una morfología muy detallada. El valor informativo de estos yacimientos de fósiles se multiplica por el hecho de que iluminan un período tan crítico y único en la historia evolutiva de la vida en nuestro planeta. Si los paleontólogos quedaron cautivados por el descubrimiento de los fósiles de Burgess Shale, es razonable suponer que estaban extasiados por el descubrimiento del lecho de fósiles de Chengjiang. En general, los organismos sin estructura esquelética rara vez dejan registros fósiles de su existencia. En el caso de la Explosión Cámbrica encontramos que las páginas del Gran Libro de Piedra de Historia Geológica que cubren la Explosión Cámbrica se encuentran entre las mejor conservadas de todo el libro.
En la época de Darwin no existía una datación precisa de las rocas por medios radiométricos. Los fósiles fueron clasificados por relaciones filogenéticas. En el momento en que se descubrieron los depósitos de fósiles de Burgess Shale, la mejor estimación de su edad fue durante el período Cámbrico, que se pensaba que comenzó hace unos 570 millones de años y terminó hace unos 570 millones de años, hace 510 millones de años. Esto dejó una ventana de 30 a 60 millones de años para la formación de fósiles de Burgess Shale. En 1993, se identificó un depósito cámbrico en Siberia que contenía cristales de circón cerca, justo encima y justo debajo. Según la datación radiométrica, se encontró que tenían 525 y 530 millones de años. Estas mediciones muy precisas reducen la ventana para la deposición de fósiles, estableciendo la explosión cámbrica de organismos vivos en un solo instante del tiempo geológico. Si tomamos la perspectiva de un día de 24 horas para representar toda la historia de la vida en la Tierra, que se estima en unos tres mil millones de años, la explosión del Cámbrico ocupó aproximadamente medio minuto antes de la primera hora de vida multicelular en la Tierra. nuestro planeta.
Este escenario guarda poca semejanza con el proceso descrito por Darwin en el que imaginó organismos vivos exhibiendo una extensa serie de numerosas y ligeras modificaciones durante un largo período de tiempo, con el resultado final siendo nuevos diseños corporales que se adaptaban mejor al medio ambiente y más supervivencia capaz.
Otro factor inesperado que caracteriza a los organismos representados por la explosión del Cámbrico es la aparición aparentemente repentina de organismos representativos de la mayoría de los filos que parecen coexistir juntos. Los filos representan los niveles más altos de divisiones de la vida animal tal como los entendemos. En un instante de tiempo geológico, aparecieron la mayoría, si no todas, las divisiones principales de la vida animal. En lugar de un desarrollo de las formas de vida más simples de abajo hacia arriba, impulsado por mutaciones genéticas fortuitas que provocarían numerosas pequeñas alteraciones en la morfología y la fisiología que resultarían beneficiosas para su supervivencia y conducirían a múltiples divisiones amplias y distintas de la vida. organismos, observamos un desarrollo aparentemente de arriba hacia abajo en el que estas principales divisiones de la vida animal exhiben muchos de los planes corporales que alguna vez han aparecido en la Tierra. Se podría concluir que la explosión del Cámbrico representa el “origen de los filos” más que el “origen de las especies”. El origen de las especies llegaría mucho más tarde como resultado de la selección y selección de formas de vida básicas, lo que en última instancia conduciría a la fenomenal diversidad de organismos vivos que todos observamos dondequiera que miremos.
Con el paso del tiempo, el dilema básico al que se enfrenta el darwinismo ha cambiado. Una vez más, Gould resume la situación de manera sucinta: "Darwin ha sido reivindicado por ricos registros precámbricos, todos descubiertos en los últimos treinta años. Sin embargo, el carácter peculiar de esta evidencia no coincide con las predicciones de Darwin de un aumento continuo de la complejidad hacia la vida en el Cámbrico, y el problema de la explosión del Cámbrico sigue siendo tan persistente como siempre, si no más, ya que nuestra confusión ahora se basa en el conocimiento más que en la ignorancia. de la naturaleza de la vida precámbrica. » (12)
¶ ¿Cuáles son los fundamentos de los organismos vivos?
Los átomos y las moléculas son los materiales de construcción de los que están hechos todos los organismos vivos. Todos los organismos vivos dependen de miles de reacciones químicas que tienen lugar de forma continua y simultánea a lo largo de su vida. Están exquisitamente coordinados, constantemente modificados y controlados por el sistema nervioso central, responden continuamente a la retroalimentación de estímulos internos, se ajustan a los cambios en el entorno externo, están dirigidos por miles de instrucciones genéticas y muy influenciados por influencias hormonales cuidadosamente equilibradas. Todos estos factores que controlan y dirigen a los seres vivos se basan en interacciones químicas en el organismo vivo. ¿Cómo puede el número limitado de elementos diferentes que componen los muchos billones de moléculas que llevan a cabo estos procesos increíblemente complejos en todos los organismos vivos cumplir funciones tan diversas y, al mismo tiempo, mantener la estabilidad y previsibilidad funcional que es tan esencial para la vida? , sigue siendo un misterio sin resolver.
Otra consideración interesante es el hecho de que el propio material del que están compuestos los organismos vivos está siendo reemplazado constantemente por otros átomos similares. Es difícil estimar la tasa de reemplazo de muchos de los átomos que componen las partes de nuestro cuerpo porque varía mucho de un tejido a otro, de un órgano a otro, sin embargo, en promedio este reemplazo se ha producido muchas veces a lo largo del tiempo. curso de toda una vida. Sabemos que las proteínas dentro de cualquier célula se construyen y descomponen constantemente y que los aminoácidos básicos se reciclan constantemente. Las células enteras también son reemplazadas constantemente por células más jóvenes. Nuestros glóbulos rojos se reciclan cada 60 o 90 días y todo el revestimiento endotelial de nuestro intestino delgado, responsable de absorber los alimentos que necesitamos, se recicla cada cinco días en promedio. (13)
¶ Tipos de enlaces químicos que mantienen unidas las piezas
En los organismos vivos, los átomos se mantienen unidos mediante una serie de enlaces químicos de diferentes tipos y longitudes variables.
Los enlaces covalentes son, con diferencia, los enlaces químicos más fuertes. Estos enlaces covalentes se forman cuando se intercambia o comparte uno o más electrones en las capas externas de dos o más átomos separados. Pueden ser simples, dobles o triples. Los enlaces covalentes dobles más comunes se encuentran entre carbono y oxígeno, carbono y nitrógeno, carbono y carbono, y fósforo y oxígeno. El enlace covalente entre fósforo y oxígeno es de particular interés porque es la energía inherente a este enlace la que se utiliza para transferir, distribuir y energizar esencialmente todas las funciones fisiológicas en todo el reino animal en forma de ATP.
Hay un grupo de enlaces no covalentes que son mucho menos energéticos pero también importantes. Los enlaces no covalentes son importantes para estabilizar macromoléculas, particularmente para mantener su configuración de plegado exacta. Entre ellos, los enlaces de hidrógeno son de gran importancia. Se forman principalmente entre hidrógeno y oxígeno e hidrógeno y nitrógeno. Son más fuertes cuando se colocan en línea recta; sin embargo, muy frecuentemente los enlaces de hidrógeno angulares no lineales contribuyen más eficazmente a estabilizar la configuración tridimensional, conocida como «conformación», de grandes moléculas de proteínas. El plegamiento preciso de las largas cadenas de aminoácidos que forman muchas proteínas macromoleculares es fundamental para su correcto funcionamiento. Un mismo compuesto proteico puede tener funciones muy diferentes según cómo esté plegado.
Los enlaces de hidrógeno prevalecen en el agua, ya sea que contenga iones disueltos o sea pura. Los enlaces de hidrógeno generalmente tienen el doble de longitud que los enlaces covalentes entre elementos similares. La longitud del enlace covalente entre el hidrógeno y el oxígeno en el agua es de aproximadamente trece nanómetros (nm), mientras que el enlace de hidrógeno entre el hidrógeno y el oxígeno en el agua tiene aproximadamente veintisiete nm de longitud. Estos son promedios porque los enlaces cambian constantemente de longitud. Consulte la Figura 3 a continuación. (Un nm es una milmillonésima parte de un metro).
Las interacciones de Van der Waals no son específicas y tienen lugar entre todos los átomos cercanos. Varían en longitud dependiendo de la distancia entre los núcleos de los átomos adyacentes. La distancia mínima está limitada por el radio de Van der Waals, que es igual al radio de la esfera atómica ocupada por un núcleo determinado y su nube asociada de electrones que lo rodea. La fuerza de atracción de Van der Waals aumenta hasta alcanzar un máximo y la fuerza repulsiva de las nubes de electrones cargados negativamente que la superponen equilibra esta fuerza de atracción. Este fenómeno se conoce como contacto de Van der Waals. La fuerza de esta atracción es débil, mide alrededor de 1 kcal por mol. (Una kcal vale mil calorías).
Otra fuerza débil interactiva no específica que actúa sobre todos los átomos y moléculas es la debida a la energía térmica. Este es el fenómeno responsable del movimiento browniano que puede observarse indirectamente mediante microscopía óptica. Todos los átomos y moléculas que se encuentran en un fluido, como líquidos y gases, están sujetos al movimiento browniano. La intensidad del movimiento browniano aumenta al aumentar la temperatura. El nivel de energía de las interacciones brownianas a la temperatura corporal es de poco menos de 1 kcal por mol.
Finalmente, existen asociaciones iónicas que tienen lugar principalmente en soluciones. Se trata de atracciones y repulsiones muy variables y débiles entre iones con cargas diferentes e iones con cargas similares, respectivamente. Estas asociaciones varían dependiendo de las concentraciones combinadas de todos los iones en una solución determinada.
Fuerzas relativas de los enlaces no covalentes:
- Paquete hidrofóbico, se produce en soluciones acuosas, conectadas a un dipolo, de muy baja energía térmica, poco menos de una kcal por mol.
- Las interacciones iónicas, muy débiles, varían según la concentración de iones en la solución.
- Interacciones de Van der Waals, aproximadamente 1 kcal por mol.
- Enlaces de hidrógeno, de 1 a 5 kcal por mol
Fuerzas relativas de varios enlaces covalentes comunes:
- hidrólisis del enlace trifosfato de adenosina (ATP), 7,3 kcal por mol
- hidrólisis del enlace fosfoéster, glicerilo -3 fosfatos, 2,2 kcal por mol.
¶ El dipolo del AGUA
Una característica única de la molécula de agua es su momento dipolar. Esto resulta de la configuración asimétrica de la molécula de H2O. Los enlaces covalentes formados por los dos átomos de hidrógeno con el átomo de oxígeno forman entre ellos un ángulo de 104,5º en lugar de los 180º que exige la simetría. (Consulte la Figura 3 a continuación) Hay una carga ligeramente positiva asociada con los átomos de hidrógeno y una carga ligeramente negativa en el extremo de oxígeno de la molécula. Debido a la asimetría, esto resulta en una ligera carga eléctrica del dipolo o momento que pasa a través de la molécula.
Este momento dipolar del agua lo convierte en un excelente disolvente. Por ejemplo, cuando se colocan cristales de cloruro de sodio en agua, los átomos de sodio y cloruro tienden a disociarse y formar iones con carga positiva y negativa, respectivamente. Debido a que el electrón externo del sodio está débilmente unido y por lo tanto tiende a ser poseído por el ion cloruro, el momento dipolar de la molécula de agua puede contribuir a este proceso atrayendo el ion sodio cargado positivamente hacia el extremo de oxígeno cargado negativamente de la molécula de agua. mientras que el extremo de hidrógeno cargado positivamente de la molécula de agua atrae al ion cloruro cargado negativamente. De manera similar, el agua es capaz de disolver muchos compuestos diferentes, contribuyendo a su estado iónico en solución. El momento dipolar de la molécula de agua también favorece la formación intensiva de enlaces de hidrógeno, tanto entre moléculas de agua como entre otras moléculas no iónicas como la glucosa, particularmente con el grupo [OH+] de la molécula de azúcar. Al igual que los cristales de sal, los cristales de azúcar se disuelven fácilmente en agua debido a este mecanismo ligeramente diferente. Este fenómeno de muchas moléculas de agua rodeando moléculas disueltas se conoce como hidratación o «empaquetamiento hidrofóbico». : esta última expresión parece no usarse en francés, al menos no la he encontrado en ninguna parte.] y tiene lugar ampliamente en asociación con muchas de las grandes macromoléculas responsables del funcionamiento de las complejas reacciones químicas que sustentan la vida. Estas reacciones tienen lugar principalmente cuando las moléculas se disuelven en agua. El agua líquida es una sustancia altamente dinámica. Las moléculas no solo están en constante movimiento debido al movimiento browniano, que está directamente relacionado con la temperatura, sino que también hay un movimiento interno constante en cada molécula de agua en el que los átomos de oxígeno e hidrógeno se mueven juntos uno con respecto al otro, provocando una ligera variación. la duración de su vínculo. Hay movimientos simétricos, movimientos asimétricos, movimientos vibratorios y movimientos oscilantes de los átomos de hidrógeno y oxígeno. En general, el movimiento del átomo de hidrógeno es mucho mayor debido a su tamaño y masa relativamente pequeños. (Ver Figura 3 a continuación) La presencia de agua en forma líquida generalmente se considera absolutamente esencial para la vida. En muchos sentidos, es el compuesto más notable que existe. El oxígeno es absolutamente esencial para la vida tal como la conocemos. El hidrógeno es, con diferencia, el elemento más abundante del universo. Cuando se juntan hidrógeno y oxígeno, se combinan explosivamente para formar agua, que es, con diferencia, el retardante más comúnmente utilizado, además de proporcionar un medio único en el que pueden ocurrir los procesos que caracterizan la vida.
¶ Moléculas de agua
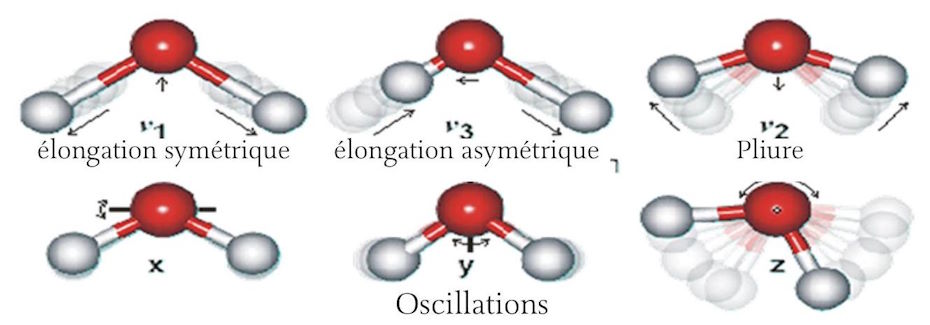
¶ La naturaleza anfótera del agua.
La naturaleza anfótera del agua es su capacidad para actuar como ácido y como base; puede donar un protón [H+] que actúa como ácido y puede aceptar un [H+] que actúa como base. El agua pura es neutra. Pero rara vez se encuentra agua pura en la naturaleza. Incluso el agua de lluvia, al condensarse en la atmósfera para formar gotas y caer a la tierra, disuelve pequeñas cantidades de dióxido de carbono del aire, formando un ácido carbónico débil.
H2O + CO2 = H2CO3
Si hay amonio presente en la atmósfera, las gotas de lluvia lo disolverán y producirán hidróxido de amonio, que es una base débil.
NH3 + H2O = NH4OH
Los átomos de agua pura se disocian parcialmente proporcionando cantidades iguales de iones hidronio.
[H3O+ o H+] e iones de hidróxido [OH-].
2 H2O = H3O+ + OH-
La concentración de iones de hidrógeno [H+] en el plasma sanguíneo es muy baja, 0,00000004 moles por litro o 4 X 10-8 moles por litro. Para evitar un número tan engorroso, introdujimos el concepto de pH, este se define como: el pH es igual a menos el logaritmo de la concentración de iones de hidrógeno [H+], expresado en moles por litro. Por tanto, la concentración de iones de hidrógeno en el plasma, expresada como pH, es 7,4. El plasma sanguíneo humano normal es de 7,3 a 7,5; el rango de pH compatible con la vida es de 6,8 a 7,8. El pH es cuidadosamente controlado primero por la frecuencia respiratoria que controla la cantidad de CO2 disuelto en el plasma, luego por los riñones que eliminan el exceso de ácido o base generado por el metabolismo mediante un complejo proceso de filtración glomerular y reabsorción tubular renal. . Como resultado, la orina normal tiende a ser ácida con un pH que oscila entre 5 y 8. El control preciso de este estrecho rango de pH plasmático es esencial para la vida porque un pH anormal puede provocar la desnaturalización de las proteínas, provocando su desarrollo y pérdida de función.
¶ Síntesis de proteínas
Las proteínas son grandes estructuras moleculares compuestas por muchos átomos de un grupo de elementos relativamente seleccionado. Estos forman largas cadenas de aminoácidos llamados polímeros. Al examinar la composición básica de los organismos vivos, uno llama la atención por la selección sorprendentemente estrecha de elementos que forman la gran mayoría de los átomos de las proteínas.
El agua es, con diferencia, el compuesto predominante en los organismos vivos; es responsable del 80 al 90% del peso corporal. Como resultado, el hidrógeno es, con diferencia, el elemento más común, responsable de aproximadamente el 50% de todos los átomos de los organismos vivos, y el oxígeno es el segundo elemento más común. Otros elementos comunes en orden de frecuencia descendente son el carbono, el nitrógeno, el fósforo y el azufre. Otros elementos adicionales que se encuentran ocasionalmente incluyen calcio, potasio, hierro, zinc, magnesio, manganeso, flúor y yodo. Todos estamos familiarizados con
Anemia por falta de hierro y bocio por falta de yodo. El número total de elementos esenciales en los seres humanos es 26, y en el caso de las bacterias es de unos 16. Las proteínas se componen de varias combinaciones de 20 aminoácidos básicos, nueve de los cuales se consideran esenciales en los seres humanos. Un aminoácido esencial es un ácido que el cuerpo humano no puede sintetizar a partir de otras fuentes de proteínas y, por lo tanto, debe suministrarse a través de la dieta de forma regular y diaria. Nuestro organismo es capaz de sintetizar los 11 aminoácidos restantes a partir de las proteínas ingeridas. Sin embargo, es importante obtener una ingesta diaria equilibrada de los nueve aminoácidos esenciales. La síntesis de proteínas depende de un suministro adecuado de todos los aminoácidos específicos necesarios. Si las cantidades de uno o más de los aminoácidos esenciales son insuficientes, la síntesis de proteínas se reducirá proporcionalmente. Un análisis cuidadoso de las proteínas vivas indica que más de 100 aminoácidos presentes resultan de modificaciones de los 20 aminoácidos básicos mediante fosforilación, glicosilación, hidroxilación, metilación, carboxilación y acetilación.
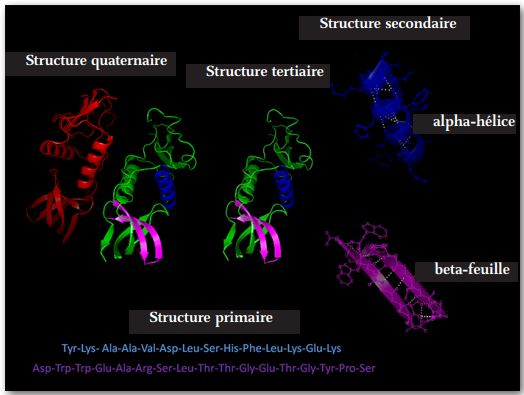
La síntesis de proteínas se lleva a cabo siguiendo cuatro pasos generalmente reconocidos. (Ver Figura 4 arriba)
El primer paso tiene lugar en los ribosomas, que son orgánulos grandes y muy complejos que residen esencialmente en todas las células. Funcionan como fábricas de proteínas. Están formados por proteínas complejas y masivas con cantidades significativas de ARN. Pueden ubicarse en las mitocondrias y el retículo endoplásmico, pero la mayoría reside en el citosol. Los ribosomas reciben instrucciones de producir una proteína específica mediante un ácido ribonucleico mensajero (ARNm) enviado desde el núcleo de la célula. Se produce por transcripción, en el núcleo, y representa una copia exacta de una única hebra corta seleccionada de ADN, excepto que los nucleótidos de timidina en el ADN son reemplazados por nucleótidos de uridina en el ARN. El ARNm proporciona información exacta sobre la secuencia de aminoácidos que deben unirse, el número de copias que deben producirse e instrucciones sobre dónde y cómo debe distribuirse la proteína recién producida. Los polímeros de menos de 40 aminoácidos de longitud generalmente se denominan péptidos. El ARN mensajero actúa como modelo y los ribosomas fabrican las partes del cuerpo adecuadas exactamente según las especificaciones.
El segundo paso tiene lugar debido a diversas interacciones no covalentes, como enlaces de hidrógeno, interacciones iónicas, fuerzas de Van der Waals e hidratación. El resultado es el plegado del polímero en varias configuraciones, las más comunes son: una bola aleatoria, una hélice alfa o una lámina beta.
La tercera etapa continúa la segunda en la que el plegamiento continúa debido a interacciones adicionales de fuerzas no covalentes. Una reversión de la tercera etapa del plegamiento molecular puede deberse a temperaturas más altas de lo normal y a fluctuaciones anormales en el nivel de pH. El despliegue interferirá con el funcionamiento normal de la proteína. Este proceso conocido como «desnaturalización» se puede revertir corrigiendo la causa subyacente.
El cuarto paso generalmente lo llevan a cabo grandes macromoléculas complejas llamadas chaperonas que a menudo exhiben una configuración de barril en la que se insertan proteínas terciarias y dentro de su cavidad las chaperonas realizan maniobras de plegado específicas cuyo resultado es una conformación correcta de la molécula. . El proceso de plegado puede requerir más de un paso, en cuyo caso la molécula puede transferirse a una segunda chaperona o cochaperona para completar el proceso de plegado. Está bien establecido que proteínas idénticas pueden realizar funciones completamente diferentes dependiendo de cómo esté plegada la molécula. Este cuarto proceso de plegamiento a menudo requiere energía, como una molécula de ATP, para completar con éxito el proceso de conformación y liberar la molécula de proteína ahora funcional en el citosol.
Las chaperonas suelen ser macromoléculas muy complejas que se han sometido a una síntesis de proteínas de cuarto paso con una chaperona especializada. Por lo tanto, tenemos una situación de “huevo y gallina”. Aquí tenemos una forma especial de complejidad irreducible en la síntesis de proteínas que depende de un sistema cuyo sistema esencial debe haber sido sintetizado antes.
¶ Compartimentación intracelular
La compartimentación intracelular es un tema de gran interés para biólogos celulares, bioquímicos y biólogos moleculares. Ha provocado un cambio de paradigma en nuestra forma de ver la morfología y fisiología celular. Durante los últimos 40 años nuestro conocimiento de los procesos intracelulares se ha disparado; Prácticamente todo sucedía en una “caja negra” en la época de Darwin. Nuestra percepción actual de las actividades internas de las moléculas en las células vivas ha sido posible gracias a una serie de asombrosas imágenes moleculares y otras técnicas de investigación que continúan avanzando rápidamente. En 1976, las imágenes de rayos X se convirtieron rápidamente en una herramienta importante para examinar la actividad molecular. A esto le siguió, a mediados de la década de 1980, la adición de imágenes por resonancia magnética nuclear (RMN) y luego, a finales de la década de 1990, la microscopía electrónica (EM). La rápida aplicación de estas herramientas al estudio de la biología celular ha dado como resultado que el número de nuevas estructuras intracelulares descubiertas cada año desde mediados de la década de 1970 crezca exponencialmente de diez a unos pocos miles. (14)
Hace cincuenta años, el concepto general de célula viva era el de un pequeño paquete de líquido proteico encerrado en una membrana de fosfolípidos de dos capas dentro de la cual se podían ver flotando varias estructuras distintas, como el núcleo y varios orgánulos pequeños. Ahora reconocemos que todo el interior de la célula está ocupado por distintas estructuras que realizan funciones específicas. Está bien establecido el concepto de que un citoesqueleto consta de microtúbulos que proporcionan pistas o cables sobre los cuales motores de transporte de diversos tipos mueven o transportan carga intracelular de un punto a otro. Ahora sabemos que el citoesqueleto es una estructura extremadamente dinámica que se construye, destruye y reajusta constantemente para adaptarse a las actividades intracelulares. Esta condición dio origen al concepto de inestabilidad dinámica. Los dominios funcionales separados dentro de la célula están asociados con proteínas transmembrana específicas, generalmente en forma de hélices alfa, responsables de la entrada o salida de fragmentos específicos, lo que en la mayoría de los casos se produce mediante transporte activo a través de la membrana celular. Las hélices alfa son proteínas tubulares, a menudo con un canal central a través del cual el agua, los iones y otros pequeños fragmentos pueden entrar o salir de la célula bajo un control cuidadoso. Proporcionan así un conducto a través del cual pasan los fragmentos sin contacto con los fosfolípidos que forman la membrana celular.
No se comprende bien por qué estos cambios dinámicos deben mantener constantemente la función celular. Sabemos que antes de la mitosis hubo un aumento de la actividad de los microtúbulos en preparación para la formación de un huso, compuesto de microtúbulos, necesario para la separación de pares de cromosomas. También se ha observado que las mitocondrias sufren constantemente alteraciones en las que hebras cortas se fusionan para producir una gran configuración de telaraña, seguida de una mayor separación en segmentos cortos. Esta podría ser una forma de eliminar parcial o completamente una mitocondria disfuncional y representar un proceso de curación o reemplazo de proteínas disfuncionales.
La compartimentación intracelular resulta primero de la distribución de orgánulos dentro de la célula. Los orgánulos se agrupan según sus funciones específicas y el grado de interrelación de sus funciones. Todos los orgánulos están esencialmente encerrados por membranas altamente especializadas. En la mayoría de las células, el retículo endoplásmico liso y el retículo endoplásmico rugoso constan de membranas significativamente plegadas; el aparato de Golgi, que también tiene una estructura plegada, y los endosomas temprano** y tardío, todos están funcionalmente vinculados y tienden a agruparse ocupando un compartimento importante en la célula. Las membranas de estos orgánulos tienden a ser compatibles, permitiendo que las moléculas de proteínas y otros fragmentos pasen de uno a otro.
Los ribosomas son macromoléculas complejas que funcionan como fábricas de proteínas y pueden unirse a una superficie membranosa como el retículo endoplásmico, que luego puede servir como área de almacenamiento o canal de distribución para proteínas recién sintetizadas. Otros están asociados con las mitocondrias. Sin embargo, muchos ribosomas se localizan de forma independiente en el citosol y liberan sus proteínas directamente. Una función importante del aparato de Golgi es marcar y preparar proteínas recién fabricadas para su entrega dentro de la célula o empaquetarlas para atravesar la membrana celular y entregarlas a un organismo distante a través del flujo sanguíneo.
El núcleo suele estar alojado en el centro de la célula y tiene grandes poros en su membrana exterior de dos capas; permite que el ARNm transmita instrucciones específicas a los ribosomas sobre exactamente qué tipo de proteína y número de copias hacer. A través de estos poros pueden pasar al núcleo ATP, así como diversos iones y otros pequeños fragmentos.
Las mitocondrias también se comunican directamente con el citosol, liberando directamente ATP fabricado. El ATP es la fuente de energía para esencialmente todas las funciones celulares. Examinaremos la ATP sintasa, que es una macromolécula compleja de gran tamaño que ha sido estudiada en detalle y representa una de las nanomáquinas más notables descubiertas hasta la fecha. Las vesículas que contienen proteínas específicas u otros fragmentos tienden a asociarse con el retículo endoplásmico desde donde se elevan desde la pared de la membrana en gemación en serie.
Otros orgánulos relativamente independientes incluyen los lisosomas que se ocupan principalmente del desmantelamiento y reciclaje de materiales intracelulares, incluidas las membranas de los orgánulos antiguos. Contienen un interior ácido necesario para reducir las proteínas a péptidos y aminoácidos. Los peroxisomas reducen los ácidos grasos y desempeñan un papel en la neutralización de las toxinas intracelulares. Las vesículas secretoras representan otro orgánulo único que contiene proteínas secretadas de diferentes fuentes y actúa como material de embalaje durante el tránsito a un sitio distante. Pueden fusionarse con la membrana celular o con determinadas membranas de orgánulos, lo que les permite liberar las proteínas que estaban almacenando. Otra estructura membranosa de la célula, considerada como orgánulo, es la de las microvellosidades. Representan una elegante adaptación que aumenta enormemente el área de absorción de las membranas celulares. Casi todo el intestino delgado está revestido de células endoteliales conocidas como enterocitos cuya superficie de absorción está completamente cubierta de microvellosidades. Las superficies de las células están literalmente salpicadas de estas proyecciones en forma de dedo meñique, un poco como las fibras de una alfombra. Aumentan muchas veces la superficie de la zona absorbente.
En el pasado se pensaba que la distribución intracelular se producía principalmente por difusión pasiva. Ahora sabemos que existe un método muy especial, preciso y bien organizado para distribuir proteínas y secreciones. Ahora reconocemos que al menos tres sistemas de transporte específicos operan esencialmente en todas las células vivas: (1) transporte seguro, (2) transporte transmembrana, (3) transporte vesicular.
- Transporte seguro se refiere al paso de moléculas a través de los poros de la membrana nuclear simulando el paso a través de una puerta abierta.
- El transporte transmembrana tiene lugar principalmente entre los orgánulos membranosos y el citosol circundante mediante un sistema de transporte activo.
- El transporte vesicular es bastante espectacular porque es un transporte activo de vesículas de diferentes tamaños, transportadas o arrastradas por una familia de proteínas motoras. Se trata de grandes macromoléculas con proyecciones en forma de tubos acopladas que «avanzan» a lo largo de los microtúbulos. Pueden ajustar su ritmo según el tamaño y la carga. Estos motores de transporte macromoleculares representan otra nanomáquina recientemente descubierta que
Está ampliamente distribuido por todo el reino animal.
El descubrimiento de estos sistemas de transporte intracelular mencionados anteriormente ha transformado la percepción de la dinámica intracelular de un entorno relativamente tranquilo, inactivo y de movimiento lento a uno que se parece mucho más a una súper autopista por la que se transportan cargas de diferentes formas y tamaños. a altas velocidades mientras esas mismas carreteras son simultáneamente desmanteladas y construidas otras nuevas.
¶ Motores de proteínas macromoleculares
Existe una familia de motores de proteínas macromoleculares que se distribuyen ampliamente en las células animales y se utilizan ampliamente para el transporte intracelular. Mueven principalmente vesículas pero también transportan orgánulos y proteínas dentro de las células. Los estudios clásicos originales de este fenómeno se llevaron a cabo en los axones de calamares gigantes. Los axones de los calamares gigantes proporcionan un modelo casi ideal para la investigación experimental sobre el transporte intracelular porque son grandes, 100 veces el ancho del axón de un mamífero promedio, y son accesibles. Debido a su gran longitud, la célula transportadora desempeña un papel importante, transportando proteínas y otros elementos esenciales, como los orgánulos, sintetizados en el cuerpo celular, hasta el final del axón. La kinesina-1 fue la proteína motora identificada y estudiada inicialmente. Se mueve en una dirección, yendo siempre hacia el extremo positivo del microtúbulo. Todos los microtúbulos tienen un extremo positivo y un extremo negativo. En las células, están orientados como los radios de una rueda y se irradian desde el centrosoma, que funciona como centro organizador de microtúbulos (MTOC). Los extremos negativos están orientados hacia el centro mientras que los extremos positivos están orientados hacia la periferia.
El motor kinesin-1 se mueve en pasos, utilizando ATP como fuente de energía. Su velocidad máxima es de tres micras por segundo, o aproximadamente 250 mm por día. (15) A esta velocidad se necesitarían unos cuatro días para recorrer la longitud de los axones humanos más largos que se extienden desde el cuerpo celular neuronal alojado en la médula espinal inferior hasta el nervio que termina en el dedo gordo del pie. A su velocidad máxima, su ‘zancada’ es de 16 millas náuticas. El motor proteico, a su máxima velocidad, da una media de 375 pasos por minuto. ¡Eso es un ritmo rápido en todos los sentidos!
Otra proteína motora ampliamente reconocida pero menos comprendida que la kinesina-1 es la dineína. Es un motor proteico orientado negativamente, por lo que se mueve en dirección opuesta en los microtúbulos. Cuando los motores proteicos llegan a su destino; en este caso el extremo negativo del microtúbulo, al ser unidireccionales, deben ser transportados pasivamente sobre el microtúbulo, hasta su punto de partida. Se desconoce exactamente cómo se encienden o apagan los motores de proteínas. Los motores pueden funcionar a diferentes velocidades. La velocidad parece depender del tamaño de la carga. Por ejemplo, la velocidad de transporte de una mitocondria es media. Las velocidades de transporte más lentas que se han medido son del orden de unos pocos milímetros por día.
Una tercera familia de motores proteicos se conoce como miosina. De los 20 miembros de esta familia, tres son importantes en los humanos. La miosina I es una molécula de una sola cabeza asociada a una membrana que funciona ampliamente en la endocitosis, proporcionando la fuerza mecánica para la constricción de la pared celular durante la división celular. La miosina V tiene dos cabezas y funciona principalmente en el transporte de orgánulos dentro de las células. La miosina II es probablemente la más común y es responsable de proporcionar la fuerza de contracción de los músculos, incluidos el músculo estriado, el músculo liso y el músculo cardíaco. La porción mecánicamente activa de las moléculas está confinada a las áreas de la cabeza y el cuello y está impulsada por ATP. Más notable que la fuerza mecánica producida por la actividad de la miosina es el asombroso control neuronal y la coordinación de los grupos de músculos que son característicos de toda función muscular voluntaria. Difícilmente se puede ver a un atleta olímpico o a un bailarín de ballet sin experimentar un estremecimiento de inspiración. La actividad muscular más sorprendente es la que demuestra el corazón humano, que comienza a latir alrededor de la sexta o séptima semana de gestación. Las mismas células musculares responsables de esos primeros latidos funcionarán continuamente durante toda la vida, latiendo aproximadamente 37 millones de veces al año durante 70, 80, 90 o incluso 100 años, para un total de 2,6 a 3,7 mil millones de veces, lo que ocurre prácticamente sin conciencia. o control consciente.
¶ Estructura y función de una nanomáquina macromolecular básica: la ATP sintasa
ATP sintasa: diagrama
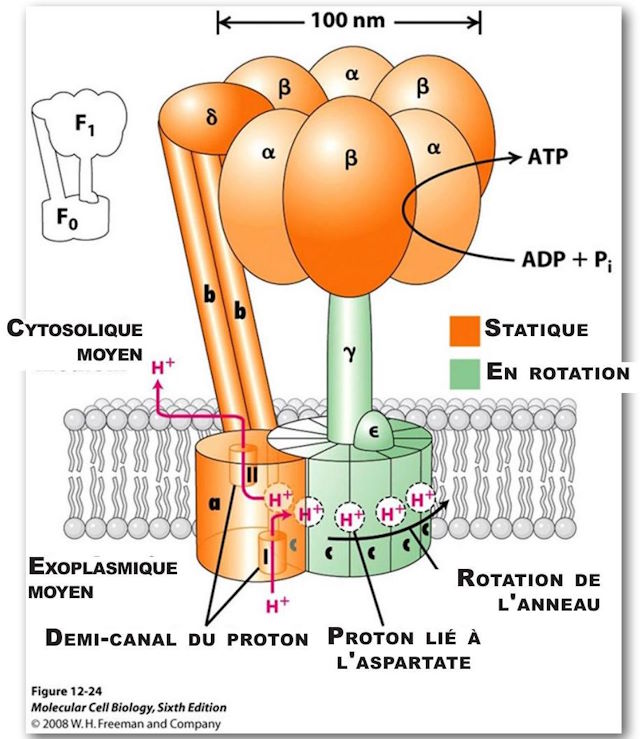
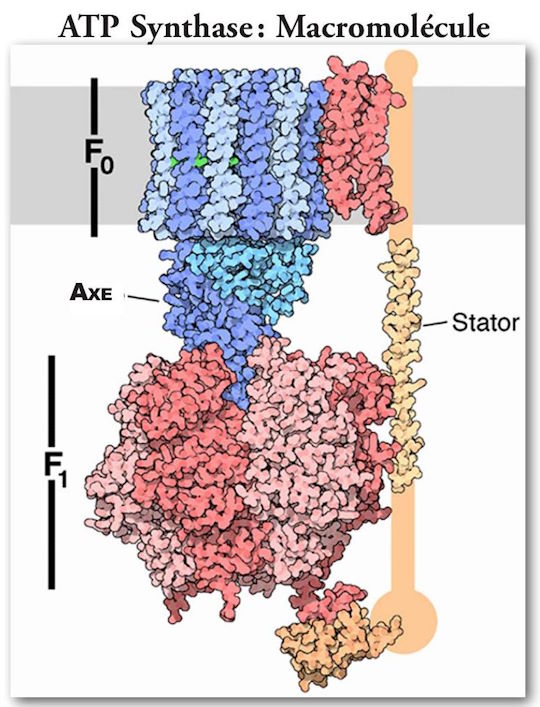
(Nota: la orientación de la Figura 6 está invertida).
(Ver Figuras 5 y 6.) Es el principal generador de ATP en todo el reino animal. Consta de dos grandes componentes multiproteicos, uno estático, de color naranja, anclado en la membrana mitocondrial, y el otro móvil, de color verde y que gira de forma muy parecida al rotor de un motor. El componente móvil es un complejo multiproteico que consta (en humanos) de 12 moléculas idénticas de forma triangular, dispuestas en una configuración cilíndrica. Tiene una estructura proteica en forma de columna unida rígidamente verticalmente de modo que cuando la estructura cilíndrica, que actúa como un rotor, gira, la columna gira con ella como un eje de transmisión. La porción cilíndrica está ubicada en el plano de la membrana mitocondrial. Cada una de las proteínas de forma triangular se denomina c. Su rotación está impulsada por protones que fluyen, uno tras otro, a lo largo de una vía que consta de dos semicanales que parten del medio exoplásmico, atraviesan la pared mitocondrial y desembocan en el medio citosólico interior. Dado que se necesita un protón para hacer girar el rotor una unidad c, en los humanos se necesitan doce protones para realizar una rotación completa.
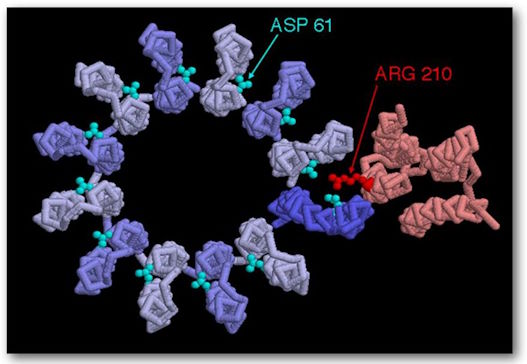
ATP sintasa, estructura, F0 vista desde arriba, que muestra las posiciones 210 en el aminoácido y las posiciones 61 en el aminoácido aspástico. Representan los sitios de unión.
Mientras que un protón que pasa por el primer medio canal, aproximadamente en el medio de la pared, interactúa con Asp (ácido aspártico)61 en su sitio de unión libre de protones, lo que resulta en el equilibrio de una carga negativa en este mismo lado del amino. ácido. También está parcialmente equilibrado por una carga positiva en Arg (arginina) 210. «El protón llena el sitio de enlace de protón vacío y al mismo tiempo desplaza a Arg 210 de la cadena lateral que se inclina hacia el sitio de enlace adyacente lleno con un protón en la subunidad c adyacente. Por tanto, el protón unido a este sitio adyacente se desplaza. El protón desplazado adyacente se mueve a lo largo del medio canal II y se libera en el espacio citosólico abandonando un sitio de unión de protones vacío en Asp 61. Una rotación levógira de todo el círculo c mueve la subunidad c »vacía" en el medio canal I. (16) La rotación es causada por un movimiento térmico/browniano y todo esto es impulsado por la “fuerza impulsora del protón”, a través de la membrana que impulsa el flujo de protones a través de esta membrana desde el ambiente exoplásmico al ambiente citosólico.
Como se dijo anteriormente, hay un componente estático que en realidad es más grande que el componente giratorio. Mide poco más de 100 nm de diámetro. Está firmemente anclado a la membrana mitocondrial. Hay dos grandes pares de estructuras lineales, con una macromolécula proteica adicional interviniendo y soportando una gran estructura en forma de toro, y que constan de tres pares de macromoléculas alternas. Estas estructuras están ubicadas en la parte superior del eje del rotor descrito anteriormente, al igual que la tapa de un hongo, está ubicada en la cola del hongo.
Los tres pares de moléculas grandes, llamadas alfa y beta, forman la estructura de la tapa y ocupan 120º cada una del círculo de 360º. Hay una molécula asimétrica unida firmemente al extremo superior del eje de rotación. Esta estructura funciona como una cámara. A medida que la leva gira, con cada segmento de giro de 120º entra en contacto íntimo con los sitios de unión de cada uno de los tres pares de macromoléculas, provocando un cambio en el estado conformacional de cada una. Hay un cambio efectivo en la forma de las estructuras proteicas que provoca un cambio en cada uno de los sitios de unión.
A medida que gira, pasa por cada una de las tres etapas en los sitios de unión. El primer paso es el de la liberación de una molécula de ATP; el segundo paso es la atracción débil de una molécula de ADP + Pi; y el tercer paso es una fuerte atracción de ADP + Pi que da como resultado una molécula de ATP fuertemente unida, lista para ser liberada al medio citosólico en el siguiente ciclo.
La velocidad de rotación se ha medido experimentalmente en aproximadamente 134 revoluciones por segundo. La velocidad de generación de moléculas de ATP se ha medido experimentalmente en unas 400 moléculas por segundo. Dado que con cada rotación se producen y liberan tres moléculas de ATP al entorno citosólico, estos valores concuerdan muy bien. Se reconocen sistemas de retroalimentación bien reconocidos que controlan la tasa de síntesis, como la concentración de ADP. También hay un acoplamiento de la oxidación de NADH y FADH2 a la síntesis de ATP, de modo que si la fuerza motriz del protón resultante no se disipa durante la síntesis de ATP, el gradiente de resistencia de la transmembrana aumentará y eventualmente bloqueará una reacción adicional.
En resumen, la ATP sintasa es una gran nanomáquina macromolecular que realiza una de las funciones más críticas en el reino bacteriano, animal y vegetal. Es un componente esencial de casi todas las células vivas. Genera el combustible necesario para todas las funciones fisiológicas principales de los organismos vivos.
Está formado por veinticinco macromoléculas distintas, de las cuales cinco son solitarias, cuatro vienen en pares y una está formada por doce copias idénticas dispuestas en una proteína compleja de forma cilíndrica que actúa como un rotor que gira a una velocidad determinada experimentalmente de 134. revoluciones por segundo (8040 revoluciones por minuto). Está ubicado de manera única en la pared de las mitocondrias y proporciona un paso para que los protones fluyan a través de la membrana a través de dos semicanales dispuestos de manera única, impulsados por la fuerza motriz del protón. (16)
Se estima que en los seres humanos la cantidad de ATP producida y utilizada cada día es aproximadamente igual al peso corporal total. Sin ATP toda la vida animal cesaría inmediatamente. De hecho, la bomba sodio-potasio, responsable de mantener la concentración relativamente negativa de sodio y relativamente positiva de potasio en todas las células, una condición esencial para todas las células, depende totalmente del ATP como fuente de energía. ¿Cómo podemos concebir que una nanomáquina macromolecular irreductiblemente compleja como la ATP sintasa, absolutamente esencial para la vida, pueda evolucionar cuando el proceso evolutivo basado en mutaciones fortuitas y la supervivencia del más fuerte depende de procesos de la vida misma que no podrían tener lugar? ¿Sin esta notable nanomáquina?
Se recomienda como seguimiento de esta presentación el vídeo animado muy detallado que representa la actividad molecular intracelular, producido en Harvard y distribuido en YouTube, titulado «La vida interior de la célula». Está ubicado en:
https://www.youtube.com/watch?v=wJyUtbn005Y
¶ Conclusión
¿Qué caracteriza a las moléculas vivas? Los elementos no difieren si forman una célula orgánica o inorgánica. Parecen idénticos e intercambiables. La característica obvia de los elementos que componen las células vivas es que realizan funciones de manera organizada. Por ejemplo, las enzimas digestivas reducen los alimentos ingeridos a componentes absorbibles que son necesarios para sustentar la vida. Luego, estos componentes se absorben, procesan, almacenan y distribuyen según sea necesario. Las células musculares participan en el movimiento y la locomoción; las células del miocardio bombean sangre día y noche, año tras año; los glóbulos rojos transportan oxígeno y dióxido de carbono (las neuronas transmiten señales eléctricas a los extremos de los músculos para desencadenar la locomoción); las células retinianas altamente especializadas transmiten datos visuales a lo largo de las vías del nervio óptico hasta la corteza occipital, donde se interpretan los fenómenos visuales; otros centros neuronales del cerebro permiten la autoconciencia, la conciencia de los demás e incluso la contemplación de la conciencia cósmica. Debido a la organización, muchas partes móviles parecen sincronizadas para que los organismos vivos puedan funcionar eficientemente. ¿De dónde viene esta organización? ¿Cómo se estableció la increíble densidad de información en las primeras moléculas de ADN? ¿Cómo podría aparecer una célula antes de que existieran las células?
Dada nuestra comprensión recientemente ampliada de las complejidades de la actividad molecular intracelular, uno podría preguntarse razonablemente: ¿existen células que no sean irreduciblemente complejas? Esto no es un menosprecio de las brillantes observaciones de Charles Darwin sobre la interrelación de todos los organismos vivos ni un cuestionamiento del hecho de la evolución. No podía imaginar las complejidades intracelulares que hemos descubierto recientemente. En su época, todo esto sucedía íntegramente en una “caja negra”
¿De dónde vino este aparente sentido de propósito que caracteriza a tantos organismos vivos? ¿La necesidad de obtener alimento, crecer, reproducirse, evitar depredadores y proteger a sus crías? ¿Cómo surgió espontáneamente el concepto de código genético? La codificación de información depende del pensamiento cognitivo de alto nivel.
¿Cómo adquirió la primera célula ATP para hacer funcionar su bomba de sodio-potasio que genera y mantiene el potencial eléctrico de la transmembrana, que es un componente absolutamente esencial de cualquier célula viva? La ATP sintasa, responsable de generar el ATP necesario para impulsar la mayoría de las funciones intracelulares, depende del gradiente de protones a través de la membrana mitocondrial como fuente de energía, así como de la cascada de transporte de electrones que produce la fuerza motriz del protón, que proporciona la energía para generar. ATP. ¿Cómo se formaron ribosomas macromoleculares grandes y complejos cuando no había fábricas de proteínas para producir los polipéptidos que los componen?
Nuestra capacidad recientemente adquirida para analizar organismos vivos a nivel molecular nos ha abierto los ojos a innumerables nanomáquinas que operan a velocidades increíblemente altas, que realizan acciones precisas con una precisión asombrosa, acciones basadas en instrucciones específicas de fuentes codificadas en bibliotecas químicas que han preservado y conservado de manera confiable. transmitió los misterios de la vida de generación en generación durante cientos de millones de años. ¡Hay tantas partes móviles! ¿Cómo evitan las colisiones? Parecen tan conectados y tan sincronizados.
Mirando hacia atrás, observamos un gigantesco Big Bang biológico hace unos 520 millones de años. De repente, muchos filos y complejos planos corporales multicelulares surgen en el paisaje marino. Desde entonces, las fuerzas creativas aparentemente explosivas del período Cámbrico han disminuido. El ritmo cambió repentinamente y aparecieron la resistencia y el ingenio. Siguió y continúa un largo período de selección, cribado y diversificación. Con una mirada escrutadora se pueden descubrir diversas formas de vida. Ahora que nosotros, el Homo sapiens, finalmente hemos llegado a la cima de la cadena alimentaria y ya no necesitamos pasar cada hora del día buscando comida o brindando protección, tenemos tiempo para pensar y mirar a nuestro alrededor. Hemos ampliado significativamente nuestra visión tanto hacia dentro como hacia fuera. Lo que estamos viendo ahora en ambas direcciones es absolutamente asombroso.
Al comienzo de mi carrera, nos costó identificar estructuras intracelulares con un microscopio óptico con una resolución de alrededor de 1 µm. El microscopio electrónico pronto amplió esta resolución en varios órdenes de magnitud, alcanzando resoluciones de unos pocos angstroms. Observamos moléculas vivas medidas en nanómetros. Las células eucariotas, que alguna vez se pensaron que eran pequeños paquetes de líquido proteico envueltos en bolsas de fosfolípidos, son en realidad fábricas complejas llenas de millones de nanomáquinas bulliciosas, que trabajan a velocidades increíbles, sin descansar nunca y completando todo el mantenimiento y las reparaciones, incluido el reemplazo por otras nuevas. máquinas, sobre la marcha. Y si esa planta resulta ser un enterocito alojado en el intestino delgado, toda la planta será reemplazada, en promedio, cada cinco días.
¿Cuántas células, cada una con miles de nanomáquinas, hay en un cuerpo humano promedio que requieren organización y supervisión? ¿Son 10 billones o 100 billones? Ambos números están impresos. Realmente no lo sabemos, pero sea lo que sea está más allá de la comprensión humana. Y, para complicar un poco más las cosas, estas fábricas no son todas iguales. Cada órgano tiene funciones muy distintas. Los glóbulos rojos transportan oxígeno desde los pulmones a los tejidos y dióxido de carbono desde los tejidos del cuerpo a los pulmones. Los glóbulos blancos combaten las infecciones, suprimen la inflamación y producen anticuerpos contra los virus invasores. Las células especializadas en los islotes de Langerhans del páncreas producen insulina, las células del hígado producen bilis, las células de la tiroides producen tiroxina, el corazón se contrae y expande mientras bombea sangre, y las neuronas interpretan los datos visuales, indican a las piernas que caminen y a las neuronas corticales cerebrales. pensar. El cerebro, por ejemplo, tiene cientos de subtipos diferentes de neuronas.
¡Tantas partes móviles! Los flagelos giran a una velocidad de 100.000 revoluciones por minuto, el motor de la ATP sintasa gira a 8.000 rpm, produciendo moléculas de ATP a una velocidad de 20.000 por minuto y proteínas motoras que transportan cargas a 8 nm por paso y a 375 pasos por minuto.
¡Tantas piezas móviles y tan rápido! Es una reminiscencia de la experiencia de asistir a un ballet. Tantos movimientos pero todos perfectamente sincronizados con la música, todos coordinados y afinados con precisión. Muy exigente en resistencia y aguante, y sin embargo sin colisiones, sin caídas ni interrupciones.
¶ ¿Dónde está el coreógrafo?
Bibliografía
- Lodish, H, et al. Biología celular molecular, W H Freeman and Company, Nueva York NY (2013) págs. 544-552.
- Savage, D. F, et al., “Arquitectura y selectividad en acuaporinas: 2.5 \AA Estructura de rayos X de la acuaporina Z”, P L_ {0} S Biology 1, no. 3 (22 de diciembre de 2003):doi: 10.1371/journal.pbio.
- Shapiro, L, Losick, R, “Localización de proteínas y destino celular en bacterias”, Science 276 (2 de mayo de 1997): 712 - 18.
- Harold, F M, The Way of the Cell, Oxford University Press, Oxford, Inglaterra (2001) págs. 65-66.
- Lili, C, “Traditional Theory of Evolution Challenge”, Beijing Review (31 de marzo – 6 de abril de 1977): 10
- Levinton, J, “The Big Bang of Animal Evolution”, Scientific American, (noviembre de 1992): 84 - 91; Kerr, R A, “El Big Bang de la evolución se vuelve aún más explosivo”, Science 621 (1993): 1274 — 75; Monastersky, R, “Big Bang biológico del reloj de rocas siberianas” Science News 144 (4 de septiembre de 1993): 148.
- Gould, SJ, La vida maravillosa, The Burgess Shale y la naturaleza de la historia W. W. Norton and Company, Inc. Nueva York, N Y (1989) p. 56.
- Chen, J Y, Li, C W, Chien, P, Zhou y Gao, F, artículo “Weng’an Biota-A Light Casting on the Precambrian World” presentado sobre el origen de los planos corporales de los animales y sus registros fósiles, China. 20-26 de junio de 1999.
- Lili, C, Chen, J Y, Zhou, G Q, Zhu, M Y, Yeh, K Y, The Chengjiang Biota: A Unique Window of the Cambrian Explosion, volumen 10.
- Gearty, W. “La explosión cámbrica: el Big Bang de la evolución”, Yale Scientific, 23:37 (23 de diciembre de 2013).
- Lee, M.S.Y., et al., “Tasas de evolución fenotípica y genética durante la explosión cámbrica, Current Biology, 23: 19, (7 de octubre de 2013) págs. 1889-1895.
- Gould, SJ, La vida maravillosa, The Burgess Shale y la naturaleza de la historia W. W. Norton and Company, Inc. Nueva York, N Y (1989) p. 57
- Lodish, H, et.al, Molecular Cell Biology, W H Freedman and Company, Nueva York, NY (2013) páginas 988-89.
- Krimm, Samuel; Bandekar, J. (1986). “Espectroscopia vibratoria y confirmación de péptidos, polipéptidos y proteínas”. Avances en la química de proteínas. Avances en química de proteínas 38 ©: 181 - 364.
- Lodish, H, et.al, Biología celular molecular, W H Freeman and Company, Nueva York, NY (2013) p. 833.
- Lodish, H, et.al, Biología celular molecular, W H Freedman and Company, Nueva York, NY (2013) p. 547.