© 2016 Ralph Zehr
© 2016 Association Francophone des Lecteurs du Livre d'Urantia
| Symposium Scientifique 2016 à Chicago | Le Lien Urantien — Numéro 75 — Septembre 2016 — Table des matières |
¶ Ralph D. Zehr
¶ Biographie professionnelle
Ralph D. Zehr a reçu son diplôme de docteur en médecine du SUNY Upstate Medical Center, Syracuse, New York, in 1964. Après un an d’internat à l’hôpital d’Harrisburg en Pennsylvanie, et une année de post-doctorat à l’université de Londres, Angleterre, où il reçut le diplôme de médecine clinique tropicale (DCTM Lon.) il a servi deux ans de plus au Ghana, Afrique occidentale). De retour aux USA, il accomplit trois ans d’internat à l’hôpital Robert Packer de Sayre, Pennsylvanie en se spécialisant en radiologie. Après avoir achevé son internat, il rejoignit immédiatement l’équipe des cadres du service médical et il a passé toute sa carrière médicale à la clinique Guthrie, un grand groupe multispécialisé régional formé de plusieurs centaines de médecins et de fournisseurs de soins primaires avec trois hôpitaux et un grand nombre de patients en consultation externe situés en zone rurale de New York sud et de la Pennsylvanie du nord. Cette unité fonctionne comme une grande infrastructure médicale intégrée centre sur les soins médicaux de haute qualité, sur la recherche médicale de base et clinique et sur un large éventail d’éducation médicale.

Il a dédié une partie significative de son temps à enseigner la radiologie à des technologues, des étudiants en médecine juniors et séniors, à des internes en radiologie et il a fait de fréquentes présentations et conférences à divers groupes de l’équipe médicale des séniors. Il a tenu un poste académique avec le SUNY Upstate Medical Center pendant de nombreuses années. Pendant dix ans, il a servi de rédacteur en chef du Guthrie Medical Journal, journal médical régional, ayant une circulation de plus de 7600 abonnés, principalement des médecins.
Pendant sa carrière, ses responsabilités administratives ont été considérables. Il a servi pendant une période de huit ans au Comité exécutif du personnel médical, y compris deux ans comme secrétaire, deux ans comme vice-président, deux ans comme président et deux ans comme ancien président. Il a été nommé président du département de radiologie nécessitant la supervision de tous les services de diagnostics radiologiques, y compris les activités d’éducation, aux trois hôpitaux et dans les cliniques pour les patients externes de la région.
Depuis lors, il n’a plus eu de responsabilités cliniques, mais il continue de servir au Conseil d’administration de la Fondation Donald Guthrie qui supervise les programmes d’éducation et de recherche, deux domaines qui ont été d’un grand intérêt personnel pendant toute sa carrière.
Préparer cette communication, centrée principalement sur la biologie moléculaire cellulaire s’est avéré une expérience vraiment passionnante. Les avances technologiques permettant d’étudier la biologie de la cellule au niveau moléculaire ont été vraiment étonnantes. De multiples façons, elles sont parallèles aux avancées qui se sont produites dans l’imagerie radiologique qui s’est poursuivies pendant toute sa carrière. De 80 à 90% des données d’imagerie générées dans le domaine de la radiologie lorsqu’il a pris sa retraite n’étaient même pas imaginées au commencement de sa carrière! Nombre de ces mêmes avancées technologiques ont contribué également à notre capacité de mettre en image l’activité intracellulaire au niveau moléculaire.
¶ Biographie personnelle
Le Livre d’Urantia, avec ses enseignements profonds et novateurs, est entré dans la vie de Ralph et de son épouse Betty à l’automne 1967 au cours d’une mission médicale au Ghana. Son effet sur leur vie fût immédiat et continue quarante années après. Les mots ne peuvent exprimer leur gratitude pour avoir trouvé le livre de si bonne heure dans leur carrière parentale et professionnelle. Betty and Ralph ont deux enfants adultes, tous deux lecteurs, et trois petits enfants. Betty est enseignante retraitée de l’école publique et spécialiste de la lecture, Ralph est un radiologiste retraité depuis 2009 après avoir accompli 45 années de pratique médicale.
Ralph est membre fondateur de l’association Urantia de Pennsylvanie où il occupe plusieurs postes exécutifs. Betty et Ralph ont organisé de nombreuses réunions biannuelles à leur domicile dans le cadre de l’association et accueillent aussi plusieurs groupes d’études depuis de nombreuses années.
Ils sont tous deux fortement impliqués à la direction de l’école UBIS dont ils font partis en tant que fidéicommissaires et donnent des cours très suivis et appréciés. Ils servent aussi dans de nombreux autres comités nationaux. Ralph est aussi un Trustee Associé de la Fondation Urantia très apprécié pour son expérience et sa serviabilité.
¶ Organismes unicellulaires L’explosion cambrienne — Nanomachines
Tant de parties mobiles — Comment s’intègrent-elles?
Par Ralph D. Zehr M.D.
¶ Les organismes unicellulaires
ON PENSE généralement que la vie a commencé sous la forme d’organisme unicellulaire. Une compréhension de la morphologie et de la fonction, en particulier des organismes unicellulaires, est donc essentielle à toute étude sérieuse de l’origine de la vie. Toutes les cellules vivantes appartiennent à l’un des deux groupes des procaryotes ou des eucaryotes.
Les procaryotes semblent beaucoup plus simples, elles sont dépourvues de la plupart des organites à l’exception des ribosomes. Elles contiennent une région dans laquelle les molécules d’ADN sont relativement concentrées dans la région centrale de la cellule, par contraste avec les eucaryotes dans lesquelles l’ADN intracellulaire est inclus dans une membrane nucléaire ou une enveloppe.
E. coli a été le procaryote le plus étudié en raison de sa simplicité, de la vitesse et de la facilité avec lesquelles il se reproduit. Son génome complet a été déchiffré. Bien que l’on aurait pu s’attendre à trouver des protéines bien plus simples et des interactions intermoléculaires moins complexes que celles observées dans les eucaryotes, cela n’a pas été le cas. La microscopie électronique a révélé une collection relativement grande de molécules d’ADN dans une zone appelée nucléoïde située au centre ou près du centre de l’organisme, de même que nombre de petits ribosomes dans le cytosol. Des processus interactifs complexes ont lieu entre l’ADN et l’ARNm ainsi que la synthèse de protéine. Les E. coli ont de multiples flagelles qui leur procurent une mobilité étonnante. Ils peuvent réagir à leur milieu en se mouvant vers les sources nutritives, de même que ralentir leur taux de métabolisme quand la nourriture se fait rare. Ils peuvent se reproduire rapidement par une division cellulaire toutes les 20 minutes dans des circonstances idéales. Un milieu de culture bien préparé, inoculé par E.coli, mis sous incubation pendant une nuit peut produire des millions d’organismes vivants identiques prêts pour l’étude le matin suivant.
On ne peut guère mentionner le rôle joué par E.coli dans la recherche sans reconnaitre comment il a contribué à élucider le « proton — force motrice » et l’hypothèse chimiosmotique associée, proposée par Peter Mitchell en 1961. Il a reconnu un lien entre le transfert d’un électron et l’adénosine triphosphate (ATP) synthase génératrice de l’ATP. Il était convaincu qu’il y avait un phénomène électrique associé au processus chimique. Il y avait un processus de transfert d’électron, dans lequel des électrons transmettent un gradient d’électron le long d’une chaine de plusieurs molécules ou le long de membranes de cellules, cédant en passant leur énergie par petits incréments. Dans ce processus, les protons s’accumulent hors de la membrane, construisant un radiant protonique connu sous le nom de « proton — force motrice ». Ils transmettent ensuite leur gradient, des machines motrices comme l’ATP synthase. Il fallut en fait quelque 16 ans pour que cette théorie soit largement acceptée. En 1978 Mitchell reçut le prix Nobel de chimie. Non seulement son hypothèse de chimioosmotique devint bien établie mais on découvrit aussi que ces phénomènes ont lieu dans nombre de bactéries, dans les mitochondries animales et dans les chloroplastes de tout le royaume des plantes. (1)
Un autre exemple de ce que nous pouvons nous attendre à trouver dans une étude ultérieure des procaryotes est la récente documentation de l’aquaporine dans E.coli, qui est hautement spécifique et montre un taux rapide d’écoulement d’eau au moyen de ses canaux. On s’attend à ce qu’elle fournisse un modèle utile à l’étude ultérieure des aquaporines qui sont un vaste complexe de protéines macromoléculaires logées dans les membranes des cellules et sont en général responsables du contrôle du flux d’eau et de glycérol dans et hors des cellules. (2)
Bien que les procaryotes montrent relativement peu de structures subcellulaires, il semble y avoir une organisation subcellulaire significative ou une compartimentation intracellulaire au niveau moléculaire. Les microbiologistes Lucy Shapiro et Richard Losick ont déclaré: « L’usage de la microscopie électronique de marquage à l’or et de la microscopie fluorescente pour étudier l’organisation subcellulaire des cellules bactériennes a révélé une extension surprenante de la compartimentation et de la localisation des protéines. » Ils poursuivent en décrivant des exemples tels que la polymérase de l’ADN, la division des cellules de protéines et le cytosquelette bactérien. (3)
Les eucaryotes peuplent les corps de tout le royaume animal et représentent notre concept général d’une cellule typique. Ils montrent une compartimentation intracellulaire extensive avec un noyau entouré par une galaxie d’organites hautement sophistiquée qui effectuent des fonctions spécifiques. Leurs systèmes énergétiques sont bien définis et hautement spécialisés. Les chloroplastes chez les plantes fonctionnent comme des panneaux solaires, transformant l’énergie du spectre visible de la lumière solaire en énergie chimique sous la forme de sucres, d’amidon, de cellulose et d’ATP, tandis que les mitochondries animales transforment l’énergie chimique stockée dans les sucres et les amidons ingérés, de même que les acides gras, en ATP. L’énergie peut aussi être extraite des protéines ingérées non nécessaires et des aminoacides si le régime en contient en surabondance.
Franklin M.Harold, professeur émérite de biochimie à l’université d’État du Colorado, dont la carrière professionnelle s’étend sur 40 ans de recherche centrée sur les micro-organismes, nous offre cette perspective intéressante sur notre com- préhension de la vie fondée sur notre connaissance des cellules. Dans son livre récent The Way of the Cell, il déclarait: « Les biochimistes insistent, à juste titre, que lorsque l’on dissèque les cellules on ne trouve rien que des molécules;pas de forces spéciales à la vie, pas de plan cosmique, que des molécules dont les contorsions et les accouplements soulignent et expliquent tout ce que fait la cellule. Ainsi, Max Perutz, réfléchissant sur les mécanismes qui permettent à E.coli de détecter une source de nutriments et de nager vers elle, n’a rien trouvé qui ne puisse être ‘réduit à la chimie’. Je partage cet engagement à une conception matérielle de la vie, mais cela rend doublement nécessaire de se rappeler qu’avant que les cellules soient disséquées, dans la mesure où elles étaient vivantes, elles montraient des capacités qui vont au-delà de la chimie. L’homéostasie, le comportement intentionnel, la reproduction, la morphogenèse et la descendance avec modification ne font pas partie du vocabulaire de la chimie mais indiquent un niveau d’ordre plus élevé. Tout comme un catalogue de petites parties s’approche de l’achèvement, la transition de la chimie moléculaire jusqu’à l’ordre supramoléculaire de la cellule émerge comme étant un prodigieux défi à l’imagination. Ne vous y trompez pas; nous touchons ici, sinon le secret même de la vie, du moins une couche essentielle de ce mystère multicouche. Car si la vie doit être expliquée de manière convaincante en termes de matière et d’énergie, l’organisation est tout ce qui sépare une soupe de produits chimiques d’une cellule vivante ». (4) (gras ajouté)
¶ L’explosion Cambrienne: Comment S’intègre-T-Elle?
Le taux attendu d’apparition de nouveaux phylums, tel que prédit par la théorie de Darwin, suivrait dans le temps une courbe relativement régulière, logarithmique ou exponentielle. Résultant de petits changements progressifs de taille et de complexité des organismes vivants et fondé sur une longue série de mutations, dues au hasard, du code génétique, suivi par des périodes intermédiaires d’essais et erreurs résultant dans la sélection des plus aptes, on pourrait s’attendre à trouver une trace de fossiles montrant les changements progressifs des phylums primitifs, qui, allant de la simple organisation et du plan du corps, passant par de nombreuses étapes progressives iraient vers des arrangements morphologiques plus complexes des parties du corps, caractéristiques des phylums plus avancés. On s’attendrait donc à voir un long spectre prolongé de nouveaux phylums s’étendant sur des siècles, montrant un motif de ramifications alors que de nouvelles formes viennent se brancher au hasard dans toutes les directions.
Mais ce n’est pas ce qui s’est passé si l’on se base sur les fossiles dont nous disposons. Au cours de l’explosion cambrienne telle qu’enregistrée dans les deux dépôts fossilifères du schiste argileux de Burgess, en Colombie britannique orientale, au Canada, découverts par Charles Doolittle Walcott en 1909 et dans les fossiles du Cambrien trouvés en Chine près de Chengjiang et plus récemment étudiés, fossiles très bien conservés et mieux décrits, il ressort une tout autre histoire. Les deux dépôts, situés à presque mi-parcours du monde l’un de l’autre, montrent une image surprenante de similitude d’un Big Bang biologique (5), (6) dans lequel de nombreux phylums et autres plan reconnus de corps ont fait leur apparition en un instant du temps géologique représentant approximativement 0,1 % de l’histoire géologique totale de la Terre.
Mais, pourquoi ne trouvons-nous pas de preuve fossilisée d’organismes précurseurs plus simples qui montreraient une progression graduelle de complexité conduisant à chaque caractéristique d’un plan unique individuel de chaque phylum ? En fait, il y a très peu de preuves de formes intermédiaires dans aucun des phylums. Les phylums identifiés montrent une stabilité morphologique considérable. En d’autres termes, nous sommes incapables d’isoler des fossiles qui montrent une preuve significative d’organismes plus simples, progressant graduellement en complexité et conduisant au plan corporel plus avancé du phylum observé. Nous ne trouvons pas non plus d’archives fossiles soit dans un temps géologique spécifique, soit dans toute l’histoire géologique, qui offrent une preuve morphologique d’une longue série d’étapes progressives graduelles liant les phylums ou confirmant une progression évolutionnaire à partir d’organismes plus simples.
Une discussion de tous les phylums identifiés dans les dépôts du cambrien est hors du cadre de cette présentation, mais une liste et une brève discussion des plus familiers semblent appropriées. Cette liste inclut: Les brachiopodes, les eldoniaiodes, les annélides, les cténophores, les hyolithes, les chordés et les arthrodades.
Les chordés, caractérisés par la présence d’une notochorde, incluent tous les vertébrés. Une découverte intéressante dans le dépôt de fossiles de Chengjiang est la présence des trois sub-phylums de chordés, les céphochordés, les craniates et les urochordés.
Dans son livre La vie merveilleuse, le schiste de Burgess et la nature de l’histoire ( Wonderful Life, The Burgess Shale and the Nature of History,) Stephen Jay Gould soulève deux questions liées à l’explosion cambrienne: (1) Pourquoi la vie multicellulaire apparaît-elle si tard ? (2) Pourquoi ces créatures anatomiquement complexes n’ont-elles pas de précurseurs directs simples dans les archives de fossiles de l’époque précambrienne ? (7)
Les dépôts fossiles de la période cambrienne en Chine montrent les détails les plus exquisément fins de même que de nombreuses parties de tissus mous: « Les sédiments du cambrien inférieur près de Chengjiang ont conservé des fossiles d’une telle excellence que des tissus et des organes mous, tels que les yeux, les intestins, les estomacs, les glandes digestives; les organes sensoriels, les épidermes, les poils, les bouches et les nerfs, peuvent être observés en détail. Même les embryons fossilisés d’éponges sont présents dans les strates du précambrien près de Chengjiang. (8)
« Les strates du niveau cambrien montrent des parties molles du corps d’organismes semblables aux méduses ( connus sous le nom d’Eldonia) telles que les canaux aqueux radiants et les anneaux des nerfs. Ces fossiles contiennent même le contenu des intestins de plusieurs sortes différentes d’animaux ainsi que le résidu de la nourriture non digérée dans leurs selles. » (9)

Des travaux récents de Michael S.Y. Lee et de ses collègues de l’université d’Adélaïde ont comparé les taux de développement évolutionnaires relatifs ainsi que les développements moléculaires au cours de l’explosion cambrienne, à celui depuis la période cambrienne jusqu’aux temps modernes. Ils ont choisi d’étudier les arthropodes car c’est un groupe tellement vaste et divers d’animaux vivants pendant la période cambrienne de même que depuis lors. Utilisant 395 caractères morphologiques, 62 gènes codants de protéines et 20 points de calibrage des archives de fossiles, les auteurs en ont inféré les histoires évolutionnaires en utilisant un certain nombre de méthodes analytiques et leur résultats de relations sont cohérents avec d’autres recherches récentes. (10) Ils en ont conclu que la vitesse d’évolution du changement morphologique au cours de la période cambrienne était de quatre fois la vitesse moyenne depuis la période cambrienne, alors que la vitesse moyenne estimée de l’évolution moléculaire pendant la période cambrienne était de cinq fois la vitesse moyenne depuis cette époque. (11) (Voir les figures 1 et 2 ci-dessous)
La vitesse de l’évolution morphologique et moléculaire des arthropodes s’est accrue de 4 à 5 fois pendant l’explosion cambrienne.
Il est très heureux que nous ayons trouvé un lit de fossiles qui recèle des spécimens aussi bien conservés dans lequel nombre des parties molles peuvent être clairement identifiées et une morphologie détaillée fine est conservée. La valeur informative de ces lits fossilifères est multipliée du fait qu’ils illuminent une telle période critique et unique de l’histoire évolutionnaire de la vie sur notre planète. Si les paléontologues ont été captivés par la découverte des fossiles du schiste de Burgess, on peut raisonnablement penser qu’ils ont été extasiés par la découverte du lit fossilifère de Chengjiang. En général, les organismes sans structure de squelette laissent rarement des archives fossiles de leur existence. Dans le cas de l’explosion cambrienne nous trouvons que les pages du grand livre de pierre de l’histoire qéologique qui couvrent l’explosion cambrienne sont parmi les mieux conservées de l’ensemble du livre.
À l’époque de Darwin, on ne disposait pas d’une datation précise des roches par des moyens radiométriques. Les fossiles étaient classés par relations phylogénétiques. À l’époque de la découverte des dépôts de fossiles du schiste de Burgess la meilleure estimation de leur âge était pendant la période cambrienne, que l’on pensait avoir commencé il y a environ 570 millions d’années et s’être achevée il y a 510 millions d’années. Ceci laissait une fenêtre de 30 à 60 millions d’années pour la formation des fossiles du schiste de Burgess. En 1993, un dépôt cambrien en Sibérie fut identifié qui contenait des cristaux de zircon tout à proximité, juste au-dessus et juste en dessous. En se basant sur la datation radiométrique on découvrit qu’ils avaient 525 et 530 millions d’années. Ces mesures très précises réduisent la fenêtre de dépôt de fossiles, établissant l’explosion cambrienne des organismes vivants à un instant du temps géologique. Si l’on se place dans la perspective d’un jour de 24 heures pour représenter la totalité de l’histoire de la vie sur terre, qui est estimée à environ trois milliard d’années, l’explosion cambrienne a occupé environ une demi-minute tôt dans la première heure de la vie multicellulaire de notre planète.
Ce scénario ressemble peu au processus décrit par Darwin dans lequel il envisageait les organismes vivants montrant une série étendue de nombreuses et légères modifications sur une longue période de temps, avec pour résultat final de nouveaux plans de corps qui étaient mieux adaptés au milieu et plus capables de survie.
Un autre facteur inattendu qui caractérise les organismes dépeints par l’explosion cambrienne est l’apparition apparemment soudaine d’organismes représentatifs de la plupart des phylums semblant coexister ensemble. Les phylums représentent les niveaux les plus élevés des divisions de la vie animale telle que nous les comprenons. En un instant du temps géologique, la plupart, si ce n’est toutes, des divisions majeures de la vie animale ont fait leur apparition. Au lieu d’un développement des formes de vie les plus simples allant du bas vers le haut, conduites par des mutations génétiques de hasard qui causeraient de nombreuses petites altérations de morphologie et de physiologie qui s’avèreraient bénéfiques pour leur survie, et conduiraient à de multiples divisions larges et distinctes des organismes vivants, nous observons un développement allant apparemment du haut vers le bas dans lequel ces divisions majeures de la vie animale montrent une grande partie des plans de corps qui aient jamais apparu sur Terre. On pourrait en conclure que l’explosion cambrienne dépeint « l’origine des phylums » plutôt que « l’origine des espèces ». L’origine des espèces viendrait beaucoup plus tard à la suite d’un tamisage et d’un triage des formes de vie de base,conduisant finalement à la diversité phénoménale des organismes vivants que nous observons tous où que nous regardions.
Le temps passant, le dilemme de base qui fait face au darwinisme a changé. De nouveau, Gould résume succinctement la situation, « Darwin a été justifié par de riches archives du précambrien, toutes découvertes au cours de dernières trente années. Pourtant, le caractère particulier de cette preuve ne correspond pas aux prédictions de Darwin d’une montée continue en complexité vers la vie du cambrien et le problème de l’explosion cambrienne demeure tout aussi persistant que jamais — si ce n’est plus, puisque notre confusion repose désormais sur la connaissance plutôt que l’ignorance de la nature de la vie précambrienne. » (12)
¶ Quels Sont Les Fondements Des Organismes Vivants?
Les atomes et les molécules sont les matériaux de construction avec lesquels sont faits tous les organismes vivants. Tous les organismes vivants dépendent de milliers de réactions chimiques qui ont lieu continuellement et simultanément tout au long de leur vie. Ils sont exquisément coordonnés, constamment modifiés et contrôlés par le système nerveux central, ils répondent de manière continue à la rétroaction des stimulus internes, s’ajustent au changement du milieu externe, ils sont dirigés par des milliers d’instructions génétiques et grandement influencés par des influences hormonales soigneusement équilibrées. Tous ces facteurs qui contrôlent et dirigent les créatures vivantes sont fondés sur les interactions chimiques dans l’organisme vivant. Comment le nombre limité d’éléments différents qui composent les nombreux billions de molécules qui effectuent ces processus incroyablement complexes dans tous les organismes vivants peuvent-ils accomplir des fonctions aussi diverses et, en même temps, maintenir la stabilité et la prédictibilité fonctionnelle qui est si essentielle à la vie, demeure un mystère non résolu.
Une autre considération intéressante est le fait que le matériau même dont sont composés les organismes vivants est constamment remplacé par d’autres atomes similaires. Il est difficile d’estimer le taux de remplacement de beaucoup d’atomes qui composent les parties de notre corps car il varie beaucoup d’un tissu à un autre, d’un organe à l’autre, cependant, en moyenne ce remplacement a lieu de nombreuses fois au cours d’une vie. Nous savons que les protéines à l’intérieur d’une cellule donnée sont constamment construites et détruites et que les aminoacides de base sont constamment recyclés. Des cellules entières sont aussi constamment remplacées par de plus jeunes cellules. Nos cellules de sang rouge sont recyclées tous les 60 ou 90 jours et toute la paroi endothéliale de notre intestin grêle, responsable de l’absorption des aliments dont nous avons besoin, est recyclée tous les cinq jours en moyenne. (13)
¶ Types de liaisons chimiques Qui maintiennent Ensemble Les Parties
Dans les organismes vivants les atomes sont maintenus ensemble par une série de liens chimiques de différents types et de longueur variable.
Les liaisons covalentes sont de loin les liens chimiques les plus forts. Ces liaisons covalentes se forment quand il y a un échange ou un partage d’un électron, ou plus, dans les couches extérieures de deux, ou plus, atomes séparés. Elles peuvent être simples, doubles ou triples. Les liaisons covalentes doubles les plus communes sont entre le carbone et l’oxygène, le carbone et l’azote, le carbone et le carbone, et le phosphore et l’oxygène. La liaison covalente entre le phosphore et l’oxygène est particulièrement intéressante parce que c’est l’énergie inhérente à ce lien qui est utilisée pour transférer, distribuer et énergiser essentiellement toutes les fonctions physiologiques dans tout le royaume animal sous la forme d’ATP.
Il y a un groupe de liaisons non-covalentes qui sont beaucoup moins énergétiques mais également importantes. Les liaisons non-covalentes sont importantes pour stabiliser les macromolécules, en particulier pour maintenir leur configuration de pliage exact. Parmi celles-ci, les liaisons hydrogènes sont d’une grande importance. Elles se forment essentiellement entre l’hydrogène et l’oxygène et l’hydrogène et l’azote. Elles sont les plus fortes quand elles sont positionnées en ligne droite, cependant, très fréquemment les liaisons hydrogènes angulaires non linéaires contribuent plus effectivement à la stabilisation de la configuration tridimensionnelle, connue sous le nom de ‘conformation’, de grandes molécules de protéines. Le pliage précis des longues chaines d’aminoacides qui forment nombre de protéines macromoléculaires est critique pour leur bon fonctionnement. Le même composé de protéine peut avoir des fonctions très différentes suivant la façon dont il est plié.
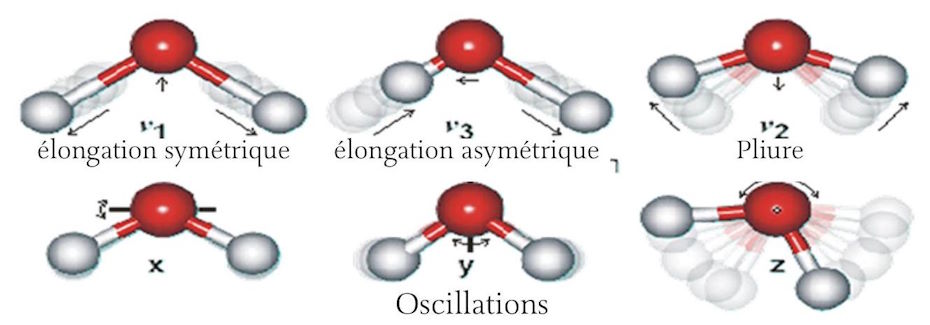
Les liaisons hydrogènes prévalent dans l’eau, qu’elle contienne des ions dissous ou qu’elle soit pure. Les liaisons hydrogènes font généralement le double de la longueur des liaisons covalentes entre les éléments semblables. La longueur de la liaison covalente entre l’hydrogène et l’oxygène dans l’eau est d’environ treize nanomètres ( nm ), tandis que la liaison hydrogène entre hydrogène et oxygène dans l’eau mesure environ vingt-sept nm de longueur. Ce sont là des moyennes car les liaisons changent constamment de longueur. Voir figure 3 ci-dessous. (Un nm est un milliardième de mètre).
Les interactions de Van der Waals ne sont pas spécifiques et ont lieu entre tous les atomes proches. Elles varient en longueur selon la distance qui existe entre les noyaux des atomes adjacents. La distance minimale est limitée par le rayon de Van der Waals, qui est égal au rayon de sphère atomique occupée par un noyau donné et son nuage d’électrons associés qui l’entoure. La force d’attraction de Van der Waals s’accroit jusqu’à atteindre un maximum et la force de répulsion des nuages d’électrons chargés négativement et qui le chevauchent, équilibre cette force d’attraction. Ce phénomène est connu comme étant le contact de Van der Waals. La force de cette attraction est faible, elle mesure de l’ordre de 1 kcal par mole. (Une kcal vaut mille calories).
Une autre force faible interactive non spécifique qui agit sur tous les atomes et toutes les molécules est celle due à l’énergie thermique. C’est le phénomène responsable du mouvement brownien qui peut être observé de manière indirecte par la microscopie optique. Tous les atomes et toutes les molécules qui sont dans un fluide, tels que les liquides et les gaz sont sujets au mouvement brownien. L’intensité du mouvement brownien s’accroit avec l’accroissement de température. Le niveau d’énergie des interactions browniennes à la température du corps est d’un peu moins de 1 kcal par mole.
Finalement, il y a les associations ioniques qui ont surtout lieu dans des solutions. Il s’agit d’attractions et de répulsions très variables et faibles entre, respectivement des ions de charges différentes des ions de charges semblables. Ces associations varient selon les concentrations combinées de tous les ions d’une solution donnée.
Forces relatives des liaisons non-covalentes:
- Paquet hydrophobe, a lieu dans des solutions d’eau, relié à un dipôle, très faible énergie thermale, un peu moins d’une kcal par mole.
- Interactions ioniques, très faibles, varient selon la concentration des ions dans la solution.
- Interactions de Van der Waals, environ 1 kcal par mole.
- Liaisons hydrogènes, de 1 à 5 kcal par mole
Forces relatives de plusieurs liaisons covalentes communes:
- hydrolyse de la liaison adénosine triphosphate (ATP), 7,3 kcal par mole
- hydrolyse de la liaison phosphoester, glyceryl -3 phosphates, 2,2 kcal par mole.
¶ Le monent diPôle de L’EAU
Une caractéristique unique de la molécule d’eau est son moment dipôle. Cela résulte de la configuration asymétrique de la molécule d’H2O. Les liaisons covalentes formées par les deux atomes d’hydrogène avec l’atome d’oxygène font entre elles un angle de 104, 5º plutôt que les 180º exigées par la symétrie. (Voir figure 3 ci-dessous) Il y a une charge légèrement positive associée aux atomes d’hydrogènes et une charge légèrement négative à l’extrémité oxygène de la molécule. En raison de l’asymétrie, il en résulte une légère charge électrique du dipôle ou moment qui traverse la molécule.
Ce moment dipôle de l’eau fait d’elle un excellent solvant. Par exemple, quand des cristaux de chlorure de sodium sont mis dans l’eau, les atomes de sodium et ceux de chlorure tendent à se dissocier et à former des ions qui sont respectivement chargés positivement et négativement. Du fait que l’électron extérieur du sodium est faiblement attaché et donc tend à être la possession de l’ion chlorure, le moment dipôle de la molécule d’eau peut contribuer à ce processus en attirant l’ion sodium chargé positivement vers l’extrémité oxygène charqée négativement de la molécule d’eau, alors que l’extrémité hydrogène de la molécule d’eau chargée positivement attire l’ion chlorure chargé négativement. D’une manière similaire, l’eau est capable de dissoudre de nombreux composés différents, contribuant à leur statut ionique en solution. Le moment dipôle de la molécule d’eau est aussi productif d’une formation intensive de liaisons hydrogènes, à la fois entre les molécules d’eau et entre d’autres molécules non-ioniques telles que le glucose, en particulier avec le groupe [OH+] de la molécule de sucre. De façon similaire aux cristaux de sel, les cristaux de sucre se dissolvent facilement dans l’eau en raison de ce mécanisme légèrement différent. Ce phénomène de nombreuse molécules d’eau entourant des molécules dissoutes est connu sous le nom d’hydratation ou ‘paquet hydrophobe’ [ N.D.T. : cette dernière expression semble ne pas être utilisée en français, du moins je ne l’ai trouvé nulle part.] et il a lieu extensivement en association avec beaucoup de grandes macromolécules responsables du fonctionnement des réactions chimiques complexes qui maintiennent la vie. Ces réactions ont lieu essentiellement quand les molécules sont dissoutes dans l’eau. L’eau liquide est une substance hautement dynamique. Non seulement les molécules sont en mouvement constant du fait du mouvement brownien qui est directement lié à la température, mais il y a un mouvement interne constant dans chaque molécule d’eau dans laquelle les atomes d’oxygène et d’hydrogène se meuvent l’un par rapport à l’autre en causant une légère variation dans la longueur de leur liaison. Il y a des mouvements symétriques, des mouvements asymétriques, des mouvements vibratoires et des mouvements de bascule des atomes d’hydrogène e d’oxygène. En qénéral, le mouvement de l’atome d’hydrogène est bien plus grand en raison de sa taille et de sa masse relativement plus petites. (Voir figure 3 ci-dessous) La présence d’eau sous forme liquide est qénéralement considérée comme absolument essentielle à la vie. En bien des manières, c’est le composé le plus remarquable de l’existence. L’oxygène est absolument essentiel à la vie telle que nous la connaissons. L’hydrogène est, de loin, l’élément le plus abondant de l’univers. Quand l’hydrogène et l’oxygène sont mis ensemble, ils se combinent de façon explosive pour former de l’eau qui est, de loin, le retardateur le plus couramment utilisé de même qu’il fournit un milieu unique dans lequel les processus qui caractérisent la vie peuvent se produire.
¶ Les Molécules d’Eau
¶ La nature amphotérique de l’eAu
La nature amphotérique de l’eau est sa capacité d’agir tant comme un acide que comme une base; elle peut donner un proton [H+] agissant comme un acide et peut accepter un [H+] agissant comme une base. L’eau pure est neutre. Mais une eau pure se trouve rarement dans la nature. Même l’eau de pluie, en se condensant dans l’atmosphère pour former des gouttelettes et tombant sur la terre, dissout de petites quantités de dioxyde de carbone provenant de l’air qui forment un acide carbonique faible.
H2O + CO2 = H2CO3
Si de l’ammonium est présent dans l’atmosphère, il sera dissout par les gouttes de pluie qui tombent et produira un hydroxyde d’ammonium qui est une base faible.
NH3 + H2O = NH4OH
Les atomes d’eau pure se dissocient en partie en fournissant des quantités égales d’ions hydronium
[H3O+ or H+] et d’ions hydroxydes [OH-].
2 H2O = H3O+ + OH-
La concentration d’ions hydrogènes [H+] dans le plasma sanguin est très basse, 0,00000004 moles par litre ou 4 X 10-8 moles par litre. Pour éviter un nombre aussi peu maniable, on a introduit le concept de pH , celui-ci est défini par: le pH est égal à moins le logarithme de la concentration d’ions hydrogènes [H+], exprimé en moles par litre. Ainsi, la concentration d’ions hydrogènes dans le plasma, exprimé en pH , est 7,4. Le plasma sanguin humain normal est de 7,3 à 7,5 ; la fourchette de pH compatible avec la vie est de 6,8 à 7,8 . Le pH est soigneusement contrôlé tout d’abord par le taux respiratoire qui contrôle la quantité de CO2 dissoute dans le plasma, puis par les reins qui éliminent les excès d’acide ou de base générés par le métabolisme au moyen d’un processus complexe de filtration glomérulaire et de réabsorption tubulaire rénale. Il en résulte que l’urine normale tend à être acide avec un pH variant de 5 à 8 . Un contrôle précis de cette fourchette étroite du pH dans le plasma est essentiel à la vie car un pH anormal peut avoir pour résultat une dénaturation des protéines, causant un dépliage et une perte de fonction.
¶ La synthèse des protéines
Les protéines représentent de vastes structures moléculaires composées de nombreux atomes d’un groupe relativement choisi d’éléments. Ceux-ci forment de longues chaines d’aminoacides dénom- mées polymères. En examinant la composition de base des organismes vivants on est frappé par la sélection étonnamment étroite des éléments qui forment la grande majorité des atomes des protéines.
L’eau est de loin le composé qui prévaut dans les organismes vivants, elle est responsable de 80 à 90% du poids du corps. En conséquence, l’hydrogène est de loin l’élément le plus répandu, responsable d’environ 50% de tous les atomes des organismes vivants, et l’oxygène est le second élément le plus commun. Les autres éléments communs par ordre de fréquence descendant sont le carbone, l’azote, le phosphore et le soufre. D’autres éléments additionnels que l’on rencontre occasionnellement incluent le calcium, le potassium, le fer, le zinc, le magnésium, le manganèse, le fluor, et l’iode. Nous sommes tous familiers avec
L’anémie due à un manque de fer et le goitre dû à un manque d’iode. Le nombre total d’éléments essentiels chez les humains est de 26, et pour les bactéries il est d’environ 16. Les protéines sont composées de diverses combinaisons de 20 aminoacides de base, dont neuf sont considérés comme essentiels chez les humains. Un aminoacide essentiel est un acide que le corps humain est incapable de synthétiser à partir d’autres sources de protéines et qui doit donc être fourni par le régime alimentaire sur une base quotidienne régulière. Notre corps est capable de synthétiser les 11 aminoacides restants à partir de protéines ingérés. Cependant, il est important d’obtenir une prise bien équilibrée des neuf aminoacides essentiels sur une base quotidienne. La synthèse des protéines dépend d’une fourniture adéquate de tous les aminoacides spécifiques requis. Si les quantités de l’un, ou de plusieurs, des aminoacides essentiels sont insuffisantes, la synthèse des protéines sera réduite en proportion. Une analyse soigneuse des protéines vivantes indique que plus de 100 aminoacides présents résultent de modifications des 20 aminoacides de base par phosphorylation, glycosylation, hydroxylation, méthylation, carboxylation et acétylation.
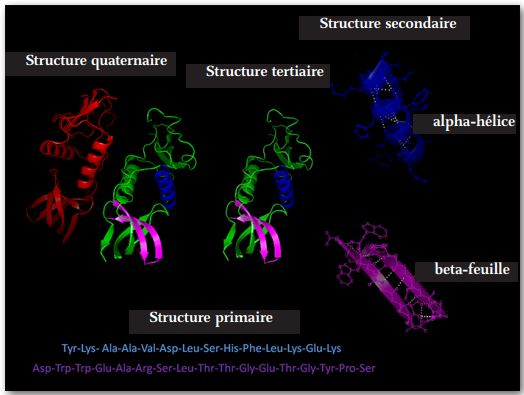
La synthèse de protéines a lieu suivant quatre étapes généralement reconnues. (Voir figure 4 ci-dessus)
La première étape a lieu dans les ribosomes qui sont de grands organites très complexes qui logent essentiellement dans toutes les cellules. Ils fonctionnent comme des usines à protéines. Ils consistent en des protéines complexes et massives avec des quantités significatives d’ARN. Ils peuvent être situés dans les mitochondries et le réticulum endoplasmique mais la plupart logent dans le cytosol. Les ribosomes reçoivent des directives pour produire une protéine spécifique au moyen d’un acide ribonucléique messager (ARNm) expédié par le noyau de la cellule. Il est produit par transcription, dans le noyau, et représente une copie exacte d’un brin d’ADN sélectionné unique et court, sauf que les nucléotides de la thymidine dans l’ADN sont remplacés par des nucléotides d’uridine dans l’ARN. L’ARNm fournit une information exacte quant à la séquence des aminoacides qui doivent être liés entre eux, le nombre de copies à produire et les directives quant au lieu et à la manière dont la nouvelle protéine produite devrait être distribuée. Les polymères de moins de 40 aminoacides de longueur sont généralement dénommés peptides. L’ARN messager fait office de plan et les ribosomes manufacturent les parties du corps appropriées exactement selon les spécifications.
La deuxième étape a lieu en raison de diverses interactions non-covalentes telles que la liaison hydrogène, les interactions ioniques, les forces de Van der Waals, et l’hydratation. Le résultat en est le pliage du polymère en diverses configurations, dont les plus communes sont: une pelote aléatoire, une hélice alpha ou une feuille bêta.
La troisième étape continue la seconde en ce que le pliage se poursuit en raison d’autres interactions des forces non-covalentes. Une réversion de la troisième étape de pliage moléculaire peut être due à des températures plus élevées que la normale et à des fluctuations anormales du niveau de pH . Le dépliage interfèrera avec le fonctionnement normal de la protéine. Ce processus connu sous le nom de ‘dénaturation’ peut être inversé en corrigeant la cause sous-jacente.
La quatrième étape est d’ordinaire exécutée par de grandes macromolécules complexes appelées chaperons qui exhibent souvent une configuration en tonneau dans lequel des protéines tertiaires sont insérées et dans leur cavité les chaperons accomplissent des manœuvres de pliage spécifiques dont le résultat est une conformation correcte de la molécule. Le processus de pliage peut nécessiter plus d’une étape, auquel cas, la molécule peut être transférée à un second chaperon ou co-chaperon pour que s’achève le processus de pliage. Il est bien établi que des protéines identiques peuvent accomplir des fonctions entièrement différentes selon le pliage de la molécule. Ce quatrième processus de pliage nécessite souvent de l’énergie telle qu’une molécule d’ATP pour parvenir à achever le processus de conformation et relâcher la molécule de protéine maintenant fonctionnelle dans le cytosol.
Les chaperons sont d’ordinaire des macromolécules très complexes qui ont elles-mêmes subi une synthèse protéinique de quatrième étape avec un chaperon spécialisé. Ainsi, nous avons une situation « d’œuf et de la poule ». Ici nous avons une forme spéciale de complexité irréductible dans la synthèse de protéine qui dépend d’un système dont le système même qui est indispensable doit avoir été synthétisé auparavant.
¶ La Compartimentation Intracellulaire
La compartimentation intracellulaire est un sujet de grand intérêt pour les biologistes de la cellule, les biochimistes et les biologistes moléculaires. Elle a amené un changement de Paradigme dans notre façon de voir la morphologie et la physiologie cellulaire. Au cours des 40 dernières années notre connaissance des processus intracellulaires a connu une explosion; virtuellement tout se passait dans une « boite noire » au temps de Darwin. Notre perception actuelle des activités internes des molécules des cellules vivantes a été rendue possible grâce à une série d’imagerie moléculaire étonnante et autres techniques d’investigation qui continuent de progresser rapidement. En 1976 l’imagerie des rayons X est rapidement devenue un outil majeur d’examen de l’activité moléculaire. Elle fut suivie au milieu des années 1980 par l’addition de l’imagerie de la résonance magnétique nucléaire (RMN) puis à la fin des années 1990 par la microscopie électronique (ME). L’application rapide de ces outils à l’étude de la biologie cellulaire a abouti à ce que le nombre de structures intracellulaires nouvelles découvertes chaque année depuis le milieu des années 1970 a crû de manière exponentielle de dix à quelques milliers. (14)
Il y a cinquante ans, le concept général d’une cellule vivante était celui d’un petit paquet de fluide protéinique enfermé dans une membrane phospholipidique à deux couches dans lequel on pouvait voir flotter diverses structures distinctes telles que le noyau et plusieurs petits organites. Nous reconnaissons maintenant que tout l’intérieur de la cellule est occupé par des structures distinctes qui accomplissent des fonctions précises. Le concept selon lequel un cytosquelette consistant en microtubules qui fournissent des pistes ou des câbles sur lesquels des moteurs de transport de divers types se meuvent ou transportent une charge intracellulaire d’un point à un autre, est bien établi. Nous savons maintenant que le cytosquelette est une structure extrêmement dynamique qui est constamment construite, détruite et réajustée afin de s’adapter aux activités intracellulaires. Cette condition a qénéré le concept d’instabilité dynamique. Des domaines fonctionnels séparés à l’intérieur de la cellule sont associés aux protéines spécifiques transmembranaires, généralement sous la forme d’hélices alpha, responsables de l’entrée ou de la sortie des fragments spécifiques, qui se font, dans la plupart des cas, par un transport actif à travers la membrane de la cellule. Les hélices alpha sont des protéines tubulaires, souvent avec un canal central par lequel l’eau, les ions et d’autres petits fragments peuvent entrer ou sortir de la cellule sous un contrôle soigneux. Elles fournissent ainsi un conduit par lequel les fragments passent sans contact avec les phospholipides qui forment la membrane de la cellule.
On ne comprend pas bien pourquoi ces changements dynamiques doivent maintenir constamment la fonction cellulaire. On sait qu’avant la mitose il y avait recrudescence de l’activité microtubulaire en préparation de la formation en fuseau, composé de microtubules, nécessaires à la séparation des paires de chromosomes. On a aussi observé que les mitochondries subissent constamment des altérations au cours desquelles des brins courts fusionnent pour produire une vaste configuration en toile d’araignée, suivie par une nouvelle séparation en courts segments. Ce pourrait être un moyen d’éliminer en partie ou en entier une mitochondrie dysfonctionnelle, et représenter un processus de guérison ou de remplacement des protéines dysfonctionnelles.
La compartimentation intracellulaire résulte d’abord de la distribution des organites dans la cellule. Les organites sont groupés selon leurs fonctions spécifiques et le degré d’interrelation de leurs fonctions. Les organites sont tous essentiellement renfermés par des membranes hautement spécialisées. Dans la plupart des cellules, le réticulum endoplasmique lisse et le réticulum endoplasmique rugueux consistent tous deux en des membranes considérablement pliées, l’appareil de Golgi, qui a aussi une structure pliée, et les endosomes précoces et tardifs, tous sont reliés fonctionnellement et tendent à se regrouper en occupant un compartiment majeur dans la cellule. Les membranes de ces organites ont tendance à être compatibles, permettant aux molécules de protéines et autres fragments de passer de l’une à l’autre.
Les ribosomes sont des macromolécules complexes qui fonctionnent comme des usines à protéines et peuvent être attachés à une surface membraneuse telle que le réticulum endoplasmique qui peut alors servir de zone de stockage ou de canal de distribution pour les protéines récemment synthétisées. D’autres sont associés à la mitochondrie. Nombre de ribosomes, cependant, sont localisés indépendamment dans le cytosol et relâchent leurs protéines directement. Une fonction majeure de l’appareil de Golgi est de marquer et préparer les protéines nouvellement manufacturées pour les livrer à l’intérieur de la cellule ou les empaqueter pour le passage au travers de la membrane cellulaire et les livrer à un site distant de l’organisme par le flux sanguin.
Le noyau est généralement logé au centre de la cellule et comporte de grands pores dans sa membrane extérieure à deux couches; il permet à l’ARNm de transmettre des instructions spécifiques aux ribosomes en ce qui concerne exactement le type de protéine et le nombre de copies à manufacturer. L’ATP ainsi que divers ions et autres petits fragments peuvent passer dans le noyau par ces pores.
Les mitochondries communiquent aussi directement avec le cytosol, en relâchant directement l’ATP manufacturé. L’ATP est la source d’énergie pour essentiellement toutes les fonctions cellulaires. Nous examinerons l’ATP synthase qui est une grande macromolécule complexe qui a été étudiée en détail et représente l’une des plus remarquables nanomachines découvertes à ce jour. Des vésicules contenant des protéines spécifiques ou d’autres fragments tendent à être associés avec le réticulum endoplasmique d’où elles s’élèvent de la paroi de la membrane sous forme de bourgeonnements en série.
D’autres organites relativement indépendants incluent les lysosomes qui sont principalement concernés par le démantèlement et le recyclage des matériaux intracellulaires incluant les membranes des vieux organites. Ils contiennent un intérieur acide nécessaire pour réduire les protéines en peptides et aminoacides. Les peroxisomes réduisent les acides gras et jouent un rôle dans la neutralisation des toxines intracellulaires. Les vésicules de sécrétion représentent un autre organite unique qui contient des protéines secrétées de différentes sources et qui agit comme matériau d’emballage durant le transit vers un site distant. Elles peuvent fusionner avec la membrane de la cellule ou avec certaines membranes d’organites, leur permettant de déverser les protéines qu’elles stockaient. Une autre structure en membrane de la cellule, considérée comme un organite, est celle des microvillosités. Elles représentent une adaptation élégante qui accroit beaucoup la zone d’absorption des membranes de la cellule. Presque tout le petit intestin est garni de cellules endothéliales connues sous le nom d’entérocytes sur lesquels la surface absorbante est entièrement couverte de microvillosités. Les zones de surface des cellules sont littéralement truffées de ces projections en forme de petits doigts, un peu comme les fibres d’une moquette. Ils accroissent la surface de la zone absorbante de nombreuses fois.
Dans le passé, on pensait que la distribution intracellulaire se faisait essentiellement par une diffusion passive. Nous savons maintenant qu’il y a une méthode très spéciale, précise et bien organisée pour distribuer les protéines et les secrétions. Nous reconnaissons maintenant qu’au moins trois systèmes de transport spécifiques opèrent essentiellement dans toutes les cellules vivantes: (1) le transport sécurisé, (2) le transport transmembrane, (3) le transport vésiculaire.
- Le transport sécurisé se réfère au passage des molécules au travers des pores de la membrane nucléaire simulant le passage par une porte ouverte.
- Le transport transmembrane a lieu principalement entre les organites membraneux et le cytosol alentour au moyen d’un système de transport actif.
- Le transport vésiculaire est plutôt spectaculaire en ce qu’il est un transport actif de vésicules de différentes tailles, porté ou tiré par une famille de protéines motrices. Ce sont de grandes macromolécules avec des projections en forme de tube couplés qui ‘s’avancent’ le long des microtubules. Elles peuvent ajuster leur allure selon la taille et la charge. Ces moteurs de transport macromoléculaires représentent une autre nanomachine récemment découverte qui
est largement distribuée dans tout le royaume animal.
La découverte de ces systèmes de transport intracellulaire ci-dessus, a transformé la perception de la dynamique intracellulaire d’un milieu relativement tranquille, inactif et à déplacement lent vers un milieu qui ressemble beaucoup plus à une super autoroute sur laquelle sont transportés ici et là des charges de formes et de tailles variées à grande vitesse tandis que ces mêmes autoroutes sont simultanément démantelées et que de nouvelles sont construites.
¶ Les motedrs Protéiques macromoléCUlaires
Il y a une famille de moteurs protéiques macromoléculaires qui sont largement distribués dans toutes les cellules animales et qui sont utilisés extensivement pour le transport intracellulaire. Ils déplacent prioritairement des vésicules mais aussi des organites de transport et des protéines à l’intérieur des cellules. Les études classiques originelles de ce phénomène ont été effectuées sur les axones de calmars géants. Les axones de calmars géants fournissent un modèle presque idéal pour la recherche expérimentale sur le transport intracellulaire parce qu’ils sont grands, 100 fois la largeur d’un axone d’un mammifère moyen et ils sont accessibles. En raison de sa grande longueur, la cellule de transport joue un rôle majeur, transportant les protéines et autres choses essentielles tels les organites, synthétisés dans le corps de la cellule, jusqu’à l’extrémité de l’axone. La kinésine-1 fut la protéine moteur initialement identifiée et étudiée. Elle se déplace dans une seule direction, allant toujours vers l’extrémité positive du microtubule. Les microtubules ont tous une extrémité positive et une extrémité négative. Dans les cellules, ils sont orientés comme les rayons d’une roue, rayonnant depuis le centrosome qui fonctionne comme un centre d’organisation microtubulaire (MTOC). Les extrémités négatives sont orientées vers le centre alors que les extrémités positives sont orientées vers la périphérie.
Le moteur de kinésine- 1 se meut par paliers, utilisant l’ATP comme sa source d’énergie. Sa vitesse maximum est de trois microns par seconde soit environ 250 mm par jour. (15) À cette vitesse là il faudrait environ quatre jours pour parcourir la longueur des axones humains les plus longs qui s’étendent depuis le corps de cellules neuronales logé dans la corde spinale inférieure, jusqu’au nerf qui se termine dans le gros orteil. À sa vitesse maximale, ses ‘enjambées’ sont de 16 nm . Le moteur protéique, à sa vitesse maximale, fait une moyenne de 375 pas par minute. C’est un rythme rapide quel que soit la manière dont on compte!
Un autre moteur protéique largement reconnu mais moins bien compris que le kinesine-1 est la dynéine. C’est un moteur protéique orienté négativement, il se meut donc dans la direction opposée sur les microtubules. Quand les moteurs protéiques atteignent leur destination; dans ce cas, l’extrémité négative du microtubule, du fait qu’ils sont unidirectionnels, ils doivent être transportés passivement sur le microtubule, jusqu’à leur point de départ. La façon exacte dont les moteurs protéiques sont activés ou désactivés n’est pas connue. Les moteurs peuvent fonctionner à des vitesses variées. La vitesse semble dépendre de la taille de la charge. Par exemple, la vitesse de transport d’une mitochondrie est moyenne. Les vitesses de transport les plus lentes qui ont été mesurées sont de l’ordre de quelques millimètres par jour.
Une troisième famille de moteurs protéiques est connue sous le nom de myosine. Des 20 membres de cette famille, trois sont importants chez les humains. La myosine I est une molécule à une seule tête associée à des membranes et qui fonctionne largement dans l’endocytose, elle fournit la force mécanique de constriction de la paroi de la cellule pendant la division cellulaire. La myosine V est bicéphale, elle fonctionne essentiellement dans le transport des organites à l’intérieur des cellules. La myosine II est probablement la plus répandue et elle est responsable de la fourniture de la force de contraction dans les muscles, y compris les muscles striés, les muscles lisses et le muscle cardiaque. La portion mécaniquement active des molécules est confinée dans les domaines de la tête et du cou et alimentée par ATP. Plus remarquable que la force mécanique produite par l’activité des myosines, il y a l’étonnant contrôle neural et la coordination des groupes de muscles qui est caractéristique de toute fonction volontaire des muscles. On ne peut guère observer un athlète olympique ou un danseur de ballet sans faire l’expérience d’un frisson d’inspiration. L’activité musculaire la plus étonnante est celle démontrée par le cœur humain qui commence à battre vers la 6e ou 7e semaine de gestation. Les mêmes cellules du muscle responsables de ces tout premiers battements de cœur vont fonctionner de manière continue pendant toute la vie, en battant environ 37 millions de fois par an pendant 70,80,90 ou même 100 ans pour un total de 2,6 à 3,7 milliards de fois, qui ont lieu sans pratiquement conscience ou contrôle conscient.
¶ Structure et fonction d’une nanomachine macromoléculaire de base: ATP synthase
ATP synthase: schéma
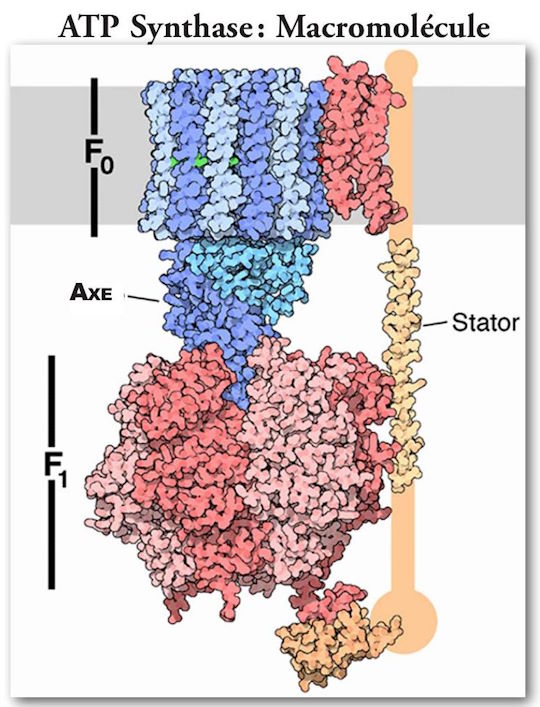
(Note: L'orientation de la figure 6 est inversée.)
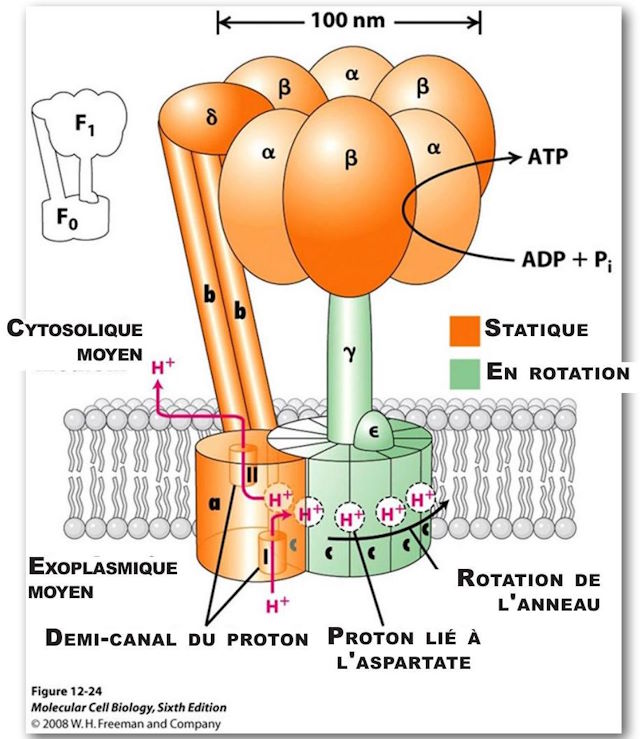
(Voir figures 5 et 6.) C’est le principal générateur d’ATP dans tout le royaume animal. Il consiste en deux grands composants de multiprotéines, l’un étant statique, de couleur orange, ancré dans la membrane mitochondriale, et l’autre mobile, de couleur verte et qui tourne un peu comme le rotor d’un moteur. Le composant mobile est un complexe multiprotéine consistant (chez les humains) en 12 molécules identiques de forme triangulaire, arrangées dans une configuration cylindrique. Il a une structure protéique en forme de colonne rigidement attachée à la verticale de sorte que quand la structure cylindrique, agissant comme un rotor, tourne, la colonne tourne avec elle comme un arbre de transmission. La portion de forme cylindrique est positionnée dans le plan de la membrane mitochondriale. Chacune des protéines de forme triangulaire est notée c. Sa rotation est alimentée par des protons qui coulent, l’un après l’autre, le long d’une voie consistant en deux demi-canaux conduisant du milieu exoplasmique, passant par la paroi mitochondriale et se vidant dans le milieu cytosolique intérieur. Puisqu’il faut un proton pour faire tourner le rotor d’une unité c, chez les humains, il faut douze protons pour fournir une rotation complète.
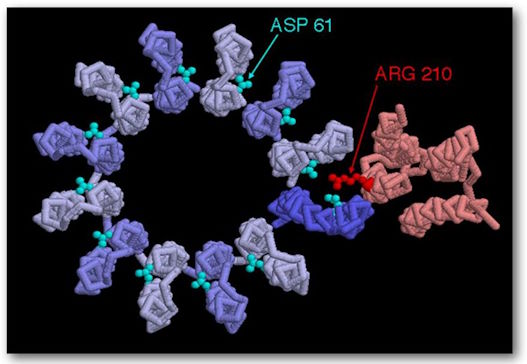
ATP Synthase, structure, F0 vue du dessus, montrant les positions 210 sur l’acide aminoacide et les positions 61 sur l’acide amino-aspatique. Ils représentent les sites de liaison.
Tandis qu’un proton qui passe par le premier demi-canal, environ au milieu de la paroi, il interagit avec l’Asp (acide aspartique)61 sur son site de liaison dépourvu de proton, ce qui a pour résultat d’équilibrer une charge négative de ce même côté de l’aminoacide. Il est aussi partiellement équilibré par une charge positive sur l’Arg (arginine) 210. « Le proton remplit le site vide de liaison protonique et en même temps déplace l’Arg 210 de la chaine latérale qui bascule sur le côté jusqu’au site de liaison adjacent empli d’un proton sur la sous-unité c adjacente. Par conséquent, le proton lié à ce site adjacent est déplacé. Le proton déplacé adjacent se déplace le long du demi-canal II et il est relâché dans l’espace cytosolique en abandonnant un site de liaison protonique vide sur Asp 61. Une rotation lévogyre de tout le cercle c déplace la sous-unité c « vide » dans le demi-canal I. (16) La rotation est causée par un mouvement thermique/brownien et tout cela est alimenté par la « force motrice du proton », au travers de la membrane qui conduit le flux de protons au travers de cette membrane depuis le milieu exoplasmique jusqu’au milieu cytosolique.
Comme il a été dit plus tôt, il y a un composant statique qui est en fait de taille plus grande que le composant en rotation. Il mesure un peu plus de 100 nm de diamètre. Il est fermement ancré à la membrane mitochondriale. Il y a deux grandes paires de structures linéaires, avec une macromolécule protéique additionnelle qui interviennent et qui soutiennent une grande structure en forme de tore, et qui consistent en trois paires de macromolécules alternées. Ces structures sont situées au sommet de l’axe du rotor décrit précédemment,un peu comme le chapeau d’un champignon, est situé sur la queue du champignon.
Les trois paires de grandes molécules, appelées alpha et bêta, forment la structure du chapeau, et occupent 120º chacune sur le cercle de 360º. Il y a une molécule asymétrique attachée fermement à l’extrémité supérieure de l’axe en rotation. Cette structure fonctionne comme une came. Tandis que la came tourne, à chaque segment de tour de 120º elle rentre en contact intime avec les sites de liaison de chacune des trois paires de macromolécules, ce qui cause un changement d’état de conformation dans chaque. Il y a un changement effectif de la forme des structures protéiques qui cause un changement dans chacun des sites de liaison.
En tournant, elle passe par chacune des trois étapes sur les sites de liaison. La première étape est celle du relâchement d’une molécule d’ATP; la deuxième étape est l’attraction faible d’une molécule d’ADP + Pi; et la troisième étape est une attraction forte de l’ADP + Pi avec pour résultat une molécule d’ATP fortement liée, prête pour être relâchée dans le milieu cytosolique lors du cycle suivant.
La vitesse de rotation a été expérimentalement mesurée à environ 134 révolutions par seconde. La vitesse de génération des molécules d’ATP a été expérimentalement mesurée à environ 400 molécules par seconde. Puisque trois molécules d’ATP sont produites et relâchées dans le milieu cytosolique à chaque rotation, ces valeurs s’accordent très bien. Des systèmes bien reconnus de ‘feedback’ qui contrôlent la vitesse de synthèse sont reconnus tels que la concentration d’ADP. Il y a aussi un couplage de l’oxydation du NADH et du FADH2 à la synthèse de l’ATP, de sorte que si la force motrice du proton qui en résulte n’est pas dissipée pendant la synthèse de l’ATP, le gradient de résistance de la transmembrane s’accroitra et finira par bloquer une réaction ultérieure.
Pour résumer, l’ATP synthase est une grande nanomachine macromoléculaire qui accomplit l’une des fonctions les plus critiques dans le royaume de la bactérie, de l’animal et de la plante. C’est un composant essentiel de presque toutes les cellules vivantes. Il génère le carburant nécessaire à la marche de toutes les fonctions physiologiques majeures des organismes vivants.
Il est formé de vingt-cinq macromolécules distinctes parmi lesquelles cinq sont solitaires, quatre vont par paire et une est faite de douze copies identiques arrangées dans une protéine complexe de forme cylindrique qui agit comme un rotor qui tourne à une vitesse expérimentalement déterminée de 134 révolutions par seconde ( 8040 révolutions par minute). Il est situé d’une manière unique dans la paroi des mitochondries et fournit un passage pour que les protons s’écoulent au travers de la membrane en traversant deux demi-canaux arrangés de manière unique, en étant conduit par la force motrice du proton. (16)
On estime que chez les humains la quantité d’ATP produite et utilisée chaque jour est approximativement égale au total du poids du corps. Sans ATP toute vie animale cesserait immédiatement. En fait, la pompe sodium-potassium, responsable du maintien de la concentration relativement négative de sodium et relativement positive de potassium dans toutes les cellules, condition essentielle à toutes les cellules, dépend totalement de l’ATP comme source d’énergie. Comment peut-on concevoir qu’une nanomachine macromoléculaire irréductiblement complexe telle que l’ATP synthase, qui est absolument essentielle à la vie, pourrait possiblement évoluer alors que le processus évolutionnaire fondé sur des mutations de hasard et sur la survie des plus aptes, dépend des processus de la vie même qui ne pourraient avoir lieu sans cette très remarquable nanomachine?
La vidéo d’animation très précise qui dépeint l’activité moléculaire intracellulaire, produite à Harvard et distribuée sur YouTube, intitulée ‘la vie intérieure de la cellule’ ( Inner Life of the Cell) est recommandée comme suite à cette présentation. Elle se trouve à:
https://www.youtube.com/watch?v=wJyUtbn005Y
¶ Conclusion
Qu’est-ce qui caractérise les molécules vivantes? Les éléments ne diffèrent pas, qu’ils composent une cellule organique ou inorganique. Ils semblent identiques et interchangeables. La caractéristique évidente des éléments composant des cellules vivantes est qu’ils accomplissent des fonctions d’une façon organisée. Par exemple, les enzymes digestives réduisent la nourriture ingérée en des parties composantes absorbables qui sont nécessaires au maintien de la vie. Ces composants sont alors absorbés, traités, mis en réserve et distribués selon les besoins. Les cellules musculaires participent au mouvement et à la locomotion; les cellules du myocarde pompent le sang jour et nuit, année après année ; les cellules du sang rouge transportent l’oxygène et le dioxyde de carbone (le gaz carbonique);les neurones transmettent des signaux électriques jusqu’aux extrémités des muscles pour déclencher la locomotion; des cellules rétiniennes hautement spécialisées transmettent les données visuelles le long des voies des nerfs optiques jusqu’au cortex occipital où les phénomènes visuels sont interprétés; d’autres centres neuraux du cerveau permettent la conscience de soi, la conscience des autres et même la contemplation de la conscience cosmique. En raison de l’organisation, tant de parties mobiles semblent synchronisées de sorte que les organismes vivants puissent fonctionner efficacement. D’où vient cette organisation? Comment l’incroyable densité de renseignements s’est-elle établie dans les premières molécules d’ADN? Comment une cellule a-t-elle pu apparaitre avant qu’il y ait des cellules?
Étant donné notre compréhension, qui s’est récemment beaucoup élargie, des complexités de l’activité moléculaire intracellulaire, on peut raisonnablement demander s’il y a des cellules qui ne soient pas irréductiblement complexes? Ce n’est pas un dénigrement des brillantes observations de Charles Darwin concernant l’interrelation de tous les organismes vivants ni la mise en question du fait de l’évolution. Il ne pouvait pas imaginer les complexités intracellulaires que nous avons découvertes récemment. À son époque, tout cela se passait entièrement dans « une boite noire »
D’où ce sens apparent de l’objectif visé qui caractérise tant d’organismes vivants venait-il? Le besoin d’obtenir de la nourriture, de croitre, de se reproduire, d’éviter les prédateurs et de protéger ses petits? Comment le concept d’un code génétique s’est-il présenté spontanément? L’encodage de l’information dépend d’une pensée cognitive de haut niveau.
Comment la première cellule a-t-elle acquis de l’ATP pour faire fonctionner sa pompe sodium-potassium qui génère et maintient le potentiel électrique de la transmembrane qui est un composant absolument essentiel de toute cellule vivante? L’ATP synthase, responsable de la génération de l’ATP requis pour alimenter la plupart des fonctions intracellulaires, dépend du gradient du proton au travers de la membrane mitochondriale pour sa source d’énergie de même que de la cascade du transport d’électron qui produit la force motrice du proton, lequel fournit l’énergie pour générer l’ATP. Comment se sont formés les grands ribosomes macromoléculaires complexes quand il n’y avait pas d’usines à protéines pour produire les polypeptides dont ils sont faits?
Notre capacité récemment acquise d’analyser les organismes vivants au niveau moléculaire nous a ouvert les yeux à d’innombrables nanomachines qui fonctionnent à des vitesses incroyablement élevées, qui accomplissent des actions précises avec une exactitude étonnante, actions fondées sur des instructions spécifiques provenant de sources codées dans des bibliothèques chimiques qui ont conservé de manière fiable et transmis les mystères de la vie de génération en génération pendant des centaines de millions d’années. Il y a tellement de parties mobiles! Comment évitent-elles les collisions? Elles semblent si reliées et si synchronisées.
En regardant en arrière, nous observons un gigantesque Big Bang biologique autour de 520 millions d’années. Soudainement, nombre de phylums et de plans de corps multicellulaires complexes jaillissent dans le paysage marin. Les forces créatives apparemment explosives de la période du cambrien se sont depuis calmées. Le tempo a soudain changé et l’endurance et l’ingénuité sont apparues. Une longue période de triage, de tamisage et de diversification a suivi et se poursuit. Des formes de vie diverses peuvent se trouver par un regard scrutateur. Maintenant que nous, les Homo sapiens sommes finalement apparus au sommet de la chaine alimentaire et que nous n’avons plus besoin de passer chaque heure d’éveil à rechercher de la nourriture ni à fournir de la protection, nous avons du temps pour penser et regarder autour de nous. Nous avons élargi notre vision de manière significative à la fois vers l’intérieur et vers l’extérieur. Ce que nous voyons maintenant dans les deux directions est absolument étonnant.
Au commencement de ma carrière nous luttions pour identifier les structures intracellulaires avec un microscope optique avec une résolution d’environ 1 μm. Le microscope électronique a bientôt étendu cette résolution de plusieurs ordres de grandeur, allant jusqu’à des résolutions de quelques angstræms. Nous avons observé des molécules vivantes mesurées en nanomètres. Les cellules eucaryotes que l’on pensait autrefois être de petits paquets de fluide protéinique enveloppés dans des poches de phospholipides, sont en fait des usines complexes remplies de millions de nanomachines qui s’affairent, travaillent à des vitesses incroyables, ne prennent jamais de repos et accomplissent toute la maintenance, toutes les réparations, y compris le remplacement par de nouvelles machines, à la volée. Et si cette usine se trouve être un entérocyte logé dans le petit intestin, toute l’usine sera remplacée, en moyenne, tous les cinq jours.
Combien de cellules, chacune contenant des milliers de nanomachines, y a-t-il dans un corps humain moyen qui nécessitent organisation et supervision? Est-ce 10 billions ou 100 billions? Les deux chiffres se trouvent imprimés. Nous ne le savons pas vraiment, mais quel qu’il soit c’est au-delà de la compréhension humaine. Et, pour compliquer un peu plus les choses, ces usines ne sont pas toutes semblables. Chaque organe a des fonctions très distinctes. Les cellules du sang rouge transportent l’oxygène depuis les poumons jusqu’aux tissus et le gaz carbonique des tissus du corps jusqu’aux poumons. Les cellules blanches du sang luttent contre les infections, suppriment l’inflammation et manufacturent des anticorps contre l’invasion de virus. Des cellules spécialisées dans les ilots de Langerhans du pancréas produisent de l’insuline, les cellules du foie produisent la bile, les cellules de la thyroïde produisent de la thyroxine, le cœur se contracte et se dilate en pompant le sang et les neurones interprètent les données visuelles, signalent aux jambes la marche et aux neurones corticaux cérébraux la pensée. Le cerveau, par exemple, a des centaines de sous-types différents de neurones.
Tant de parties mobiles! Les flagelles tournent à raison de 100000 révolutions par minute, le moteur de l’ATP synthase tourne à 8000 tr / min, produisant des molécules d’ATP au rythme de 20000 par minute et des protéines moteurs transportant des charges à 8 nm par pas et à 375 pas par minute.
Tant de parties mobiles et qui vont si vite! Cela rappelle une expérience d’assistance à un ballet. Tant de mouvements mais tous parfaitement synchronisés avec la musique, tous coordonnés et réglés avec précision. Fort exigeants en résistance et en endurance, et pourtant pas de collisions, pas de chutes ni d’interruptions.
¶ Où est le chorégraphe?
Bibliographie
- Lodish, H, et.al. Molecular Cell Biology, W H Freeman and Company, New York NY (2013) pp. 544-552.
- Savage, D. F, et al., « Architecture and Selectivity in Aquaporins: 2.5 \AA X-Ray Structure of Aquaporin Z, » P L_{0} S Biology 1, no. 3 (December 22, 2003):doi : 10.1371/journal.pbio.
- Shapiro, L, Losick, R, « Protein Localization and Cell Fate In Bacteria, »Science 276 (May 2, 1997): 712 — 18.
- Harold, F M, The Way of the Cell, Oxford University Press, Oxford, England (2001) pp. 65-66.
- Lili, C, « Traditional Theory of Evolution Challenge, » Beijing Review (31 March — 6 April 1977): 10
- Levinton, J, « The Big Bang of Animal Evolution, » Scientific American, (November 1992): 84 — 91; Kerr, R A, « Evolution’s Big Bang Gets Even More Explosive, » Science 621 (1993): 1274 — 75; Monastersky, R, « Siberian Rocks Clock Biological Big Bang » Science News 144 (4 September 1993): 148.
- Gould, S J, Wonderful Life, The Burgess Shale and the Nature of History W. W. Norton and Company, Inc. New York, N Y (1989) p. 56.
- Chen, J Y, Li, C W, Chien, P, Zhou, and Gao, F, « Weng’an Biota-A Light Casting on the Precambrian World » paper presented to the origin of animal body plans and their fossil records, China 20 — 26, June 1999.
- Lili, C, Chen, J Y, Zhou, G Q, Zhu, M Y, Yeh, K Y, The Chengjiang Biota: A Unique Window of the Cambrian Explosion, volume 10.
- Gearty, W. « The Cambrian Explosion: Evolution’s Big Bang,» Yale Scientific, 23:37 (December 23, 2013).
- Lee, M.S.Y., et al., « Rates of Phenotypic and Genetic Evolution during the Cambrian Explosion, Current Biology, 23: 19, (October 7, 2013) pp. 1889 -1895 .
- Gould, S J, Wonderful Life, The Burgess Shale and the Nature of History W. W. Norton and Company, Inc. New York, N Y (1989) p. 57
- Lodish, H, et.al, Molecular Cell Biology, W H Freedman and Company, New York, NY (2013) page 988-89.
- Krimm, Samuel; Bandekar, J. (1986). « Vibrational Spectroscopy and Confirmation of Peptides, Polypeptides, and Proteins ». Advances in Protein Chemistry. Advances in Protein Chemistry 38 ©: 181 — 364.
- Lodish, H, et.al, Molecular Cell Biology, W H Freeman and Company, New York, NY (2013) p. 833 .
- Lodish, H, et.al, Molecular Cell Biology, W H Freedman and Company, New York, NY (2013) p. 547 .
| Symposium Scientifique 2016 à Chicago | Le Lien Urantien — Numéro 75 — Septembre 2016 — Table des matières |